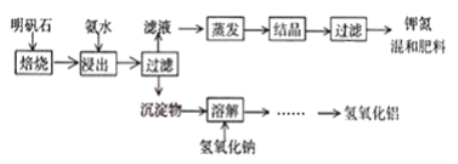
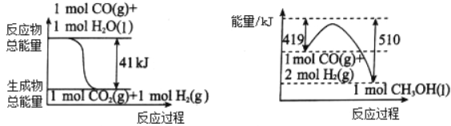
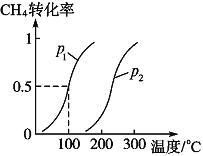
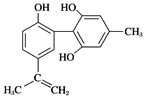
题目内容
【题目】某化学学习小组进行如下实验测定 H2C2O4·xH2O 中 x 值已知:M(H2C2O4)=90gmol-1
① 称取1.260 g 纯草酸晶体,将草酸制成 100.00 mL 水溶液为待测液;
② 取25.00 mL 待测液放入锥形瓶中,再加入适量的稀 H2SO4;
③ 用浓度为 0.05 000 mol·L-1 的 KMnO4标准溶液进行滴定。
(1)请写出滴定中发生反应的离子方程式________________________。
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是_____(选填 a、b)。
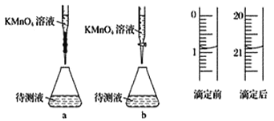
(3)由图可知消耗 KMnO4 溶液体积为________mL。
(4)滴定过程中眼睛应注视_______________,滴定终点锥形瓶内溶液的颜色变化为_______。
(5)通过上述数据,求得 x=_____。
a.若由于操作不当,滴定结束后滴定管尖嘴处有一气泡, 引起实验结果_____(填“偏大”、“偏小”或“无影响”);
b.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果_______(填“偏大”、“偏小”或“无影响”);
c.若在达到滴定终点时仰视读数,则所得结果________(填“偏大”、“偏小”或“无影响”);
d.若其它操作均正确,滴定前未用标准 KMnO4 溶液润洗滴定管,引起实验结果_________(填“偏大”、“偏小”或“无影响”)。
【答案】5H2C2O4+2MnO4- +6H+ ===10CO2 ↑+2Mn2+ +8H2O b 20.00 锥形瓶中颜色变化 溶液由无色变成紫红色,且半分钟内不褪色 2 偏小 无影响 偏大 偏大
【解析】
(1)H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水;
(2)据高锰酸钾呈酸性,盛放在酸式滴定管中来选择;
(3)根据滴定管的结构、精确度以及测量原理来解答;
(4)据滴定终点的判断是溶液中颜色的变化来分析;
(5)据此6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O离子方程式来计算;据滴定过程中眼睛应注视溶液中颜色变化,来判断滴定终点分析;根据 c(待测)=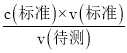 分析不当操作对V(标准)的影响,以此判断浓度的误差。
分析不当操作对V(标准)的影响,以此判断浓度的误差。
(1)H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水,其反应的离子方程式为:6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O;
(2)高锰酸钾溶液呈酸性,应盛放在酸式滴定管中,故答案为b;
(3)该仪器是酸式滴定管,滴定管滴定前后读数为:0.80mL,20.80mL,消耗KMnO4溶液体积为20.80mL-0.80mL=20.00mL;
(4)据酸性KMnO4溶液为紫红色,滴定终点时无色变为紫红色,且半分钟不褪色为滴定到终点故眼睛应注视溶液中颜色变化;
(5)6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O
5 2
n=0.00250.02×0.05
m(H2C2O4)=0.0025×90=0.225g;m(H2C2O4xH2O )=1.26×![]() =0.315g;
=0.315g;
m(H2O)=0.315-0.225=0.09g;n(H2O)=![]() mol=0.005mol①
mol=0.005mol①
又因为 n H2C2O4)=0.0025 mol根据元素守恒即n(H2C2O4xH2O )=0.0025mol;n(H2O)=0.0025x②;联立①②得0.005=0.0025x,解得x=2;
a. 滴定结束后滴定管尖嘴处有一气泡,消耗标准液的体积偏小,根据 c(待测)=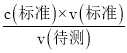 ,导致测定结果偏小;
,导致测定结果偏小;
b.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,不影响消耗标准溶液的体积,根据 c(待测)=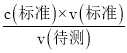 ,则测定结果无影响;
,则测定结果无影响;
c.若在达到滴定终点时仰视读数,造成V(标准)偏大,根据 c(待测)=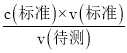 故c(待测)偏大;
故c(待测)偏大;
d.未用标准KMnO4溶液润洗滴定管,溶液被稀释,造成V(标准)偏大,根据 c(待测)=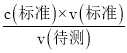 故c(待测)偏大;
故c(待测)偏大;

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】某班同学用如下实验探究Fe2+、Fe3+和FeO42-的性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是________;将FeCl3晶体溶于浓盐酸,再稀释到需要的浓度,盐酸的作用是________。
(2)制备K2FeO4(夹持装置略)后,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
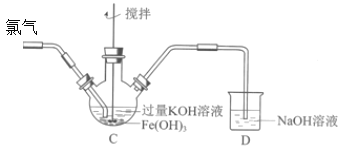
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。根据K2FeO4的制备原理3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O得出:氧化性Cl2______FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。