题目内容
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:
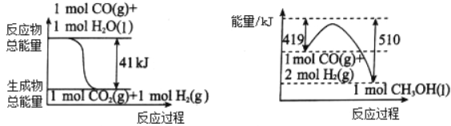
则CO2与H2反应生成CH3OH的热化学方程式为_____________________
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1>0
CO(g)+3H2(g) △H1>0
Ⅱ.CO(g)+2H2(g)![]() CH3OH(g) △H2<0
CH3OH(g) △H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。
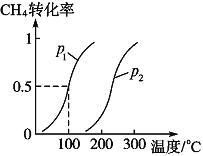
①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为________;
②图中的p1_______p2(填“<”、“>”或“=”),判断的理由是________________________。
③若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是_________(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol·L﹣1)变化如下表所示:
2min | 5min | 10min | |
CO | 0.07 | 0.06 | 0.05 |
H2 | 0.14 | 0.12 | 0.20 |
CH3OH | 0.03 | 0.04 | 0.05 |
若5min时只改变了某一条件,则所改变的条件是_____________;10min时测得各物质浓度如表,10min时v正_______v逆(填“<”、“>”或“=”)。
【答案】(1)CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;(2)①0.003mol/(L·min);②<;该反应为反应前后气体体积增大的反应,温度相同时,压强越大,CH4的转化率越小,压强为P1的CH4的转化率高,所以P1<P2;③cd④加1 mol氢气;>。
【解析】
试题分析:(1)图1中的热化学方程式为①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41kJ/mol,
②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,
依据盖斯定律②-①得:二氧化碳和氢气制备甲醇的热化学方程式:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
(2)①由图知道平衡时甲烷的转化率为0.5,所以△c(CH4)=![]() =0.005mol/L,所以v(CH4)=
=0.005mol/L,所以v(CH4)=![]() =0.001mol/(L·min),速率之比等于化学计量数之比,所以v(H2)=3v(CH4)=3×0.001mol/(L?min)=0.003mol/(L·min),故答案为:0.003mol/(L·min);
=0.001mol/(L·min),速率之比等于化学计量数之比,所以v(H2)=3v(CH4)=3×0.001mol/(L?min)=0.003mol/(L·min),故答案为:0.003mol/(L·min);
②温度相同时,作垂直x轴的辅助线,压强为P1的CH4的转化率高,反应为前后体积增大的反应,压强增大平衡向体积减小的方向移动,即向逆反应移动,CH4的转化率降低,所以P1<P2,故答案为:<;该反应为反应前后气体体积增大的反应,温度相同时,压强越大,CH4的转化率越小,压强为P1的CH4的转化率高,所以P1<P2;
③a、生成CH3OH的速率与消耗CO的速率都表示正反应速率,不能判断反应Ⅱ达到平衡状态,错误;b、容器的体积不变,气体的质量不变,混合气体的密度始终不变,不能判断反应Ⅱ达到平衡状态,错误;c、该反应属于气体的物质的量发生变化的反应,混合气体的总物质的量不变,表示反应达到了平衡状态,正确;d、CH3OH、CO、H2的浓度都不再发生变化,表示反应达到了平衡状态,正确;故选cd;
④对比6min和8min时各物质的浓度可知改变条件后反应反应向正方向进行,按照转化量之比等于计量系数之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三种物质的浓度应为:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10=1mol的氢气;该温度下,甲醇的平衡浓度是0.06mol/L,氢气的平衡浓度是0.12mol/L,一氧化碳的平衡浓度是0.04mol/L所以平衡常数K=![]() =
=![]() ≈46.3,第10min时反应的浓度商Qc=
≈46.3,第10min时反应的浓度商Qc=![]() =
=![]() =
=![]() =25<K,反应向正反应方向进行,v正>v逆,故答案为:加1 mol氢气;>。
=25<K,反应向正反应方向进行,v正>v逆,故答案为:加1 mol氢气;>。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案