题目内容
【题目】(1)基态溴原子的价层电子轨道排布式为________。第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有___________(填标号)。
A.都属于p区主族元素B.电负性都比镁大
C.第一电离能都比镁大D.氯化物的水溶液pH均小于7
(3)Al元素可形成[AlF6]3-、[AlCl4]-配离子,而B元素只能形成[BF4]-配离子,由此可知决定配合物中配位数多少的因素是________________;[AlCl4]-的立体构型名称为______。
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是________________
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是_________。

A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)F2中F-F键的键能(157kJ/mol)小于Cl2中Cl-Cl键的键能(242.7kJ/mol),原因是_________。
(6)金属钾的晶胞结构如图。若该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,则表示K原子半径的计算式为______。

【答案】![]() 4 BD 中心原子半径、配位原子的半径 正四面体 P4 、CS2是非极性分子,H2O是极性分子,根据相似相溶原理,P4难溶于水 BD F的原子半径小,孤电子对之间的斥力大
4 BD 中心原子半径、配位原子的半径 正四面体 P4 、CS2是非极性分子,H2O是极性分子,根据相似相溶原理,P4难溶于水 BD F的原子半径小,孤电子对之间的斥力大 ![]()
【解析】
(1)溴原子为35号元素,基态原子价层电子排布式[Ar] 3d104s24p5,电子排布图为:![]() ;,溴原子未成对电子数为1,与溴原子未成对电子数相同的金属元素有:K、Sc、Cr、Cu,共4种;
;,溴原子未成对电子数为1,与溴原子未成对电子数相同的金属元素有:K、Sc、Cr、Cu,共4种;
(2)铍与相邻主族的铝元素性质相似。A.Be属于s区,Al属于P区,故A错误;B.电负性都比镁大,故B正确;C.元素Be的第一电离能比Mg大,元素Al的第一电离能比Mg小,故C错误;D.氯化物的水溶液均发生水解,溶液显酸性,则PH<7, D项正确。答案选BD;
(3)B3+离子半径明显小于Al3+,则Al元素可形成[AlF6]3-,[AlCl4]-配离子,而B只能形成[BF6]3-配离子,因此,决定配合物中配位数多少的因素是中心原子(或例子)及配位原子半径的大小;[AlCl4]-的配位数是4,故立体构型为正四面体形;
(4)①P4, CS2是非极性分子,H2O是极性分子,根据相似相溶原理,P4难溶于水;②A. 由结构可知G中磷原子杂化方式为sp3杂化,故A错误;B. G中层与层之间的作用力是分子间作用力,故B正确;C. 石墨中碳原子为sp2杂化,每层原子均在同一平面内,但磷原子杂化方式为sp3杂化,每一层的各原子不可能在同一平面内,故C错误;D. 黑磷为原子晶体,而其它二种单质为分子晶体,则黑磷的熔沸点最高,故D正确;所以答案为BD;
(5)可以根据键长的大小来判断,具体来说就是根据相结合的2个原子的半径来比较,半径越小键能越大,而F的原子半径小,孤电子对之间的斥力大,导致F2中F-F键的键能(157kJ/mol)小于Cl2中Cl-Cl键的键能(242.7kJ/mol);
(6)金属钾的晶胞结构为体心立方,晶胞中K原子数目为:1+8×![]() =2,阿伏加德罗常数为NA,K原子的摩尔质量为M,故晶胞质量为:
=2,阿伏加德罗常数为NA,K原子的摩尔质量为M,故晶胞质量为:![]() ;设K原子半径为r,设晶胞棱长为l,晶胞中体对角线为4r,则(4r)2=l2+l2+l2,则l=
;设K原子半径为r,设晶胞棱长为l,晶胞中体对角线为4r,则(4r)2=l2+l2+l2,则l=![]() r,晶胞体积V=l3=(
r,晶胞体积V=l3=(![]() r)3,若该晶胞的密度为ag/cm3,则(
r)3,若该晶胞的密度为ag/cm3,则(![]() r)3×a=
r)3×a=![]() ,且M=39 g/mol整理得:r=
,且M=39 g/mol整理得:r=![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】FeCl2是一种用途广泛的化工产品。由于在水溶液中难以得到高纯度的FeCl2,某课题小组设计氯化铁和氯苯反应制得高纯度的FeCl2。
(查阅资料)①在加热条件下,氯化铁遇水剧烈水解。
②2FeCl3 +C6H5Cl →C6H4Cl2 + 2FeCl2 + HCl↑
③有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2(对二氯苯) | FeCl3 | FeCl2 | |
式量 | 112.5 | 147 | 162.5 | 127 |
溶解性 | 不溶于水,易溶于苯 | 溶于水,不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | —— | —— |
沸点/℃ | 132 | 173 | —— | —— |
(实验过程)按下图装置,在三颈烧瓶中放入a g无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯A中物质得到产品。
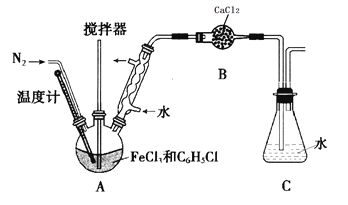
回答下列问题:
(1)实验装置中,仪器B的名称是________________。
(2)反应前后都需要通入N2的目的是_____________。
(3)实验过程中控制反应温度128~139℃,C6H5Cl不会有明显损失,原因是_____________。
(4)充分反应后,冷却。对三颈烧瓶内的物质进行过滤,用苯洗涤沉淀,干燥得到产品。回收滤液中C6H5Cl的方案为_______________。
(5)经检验产品中不含有FeCl3。取少量所得产品溶解于盐酸中,配制成溶液。向盛有H2O2溶液的试管中加入几滴配制的溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________;生成沉淀的原因是(用平衡移动原理解释)__________。