题目内容
7.有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸加热直接反应,即Cu→CuS04
②将铜加到热的稀硫酸中并通入空气来制备硫酸铜,即由Cu→CuO→CuSO4试回答:
(1)写出方案①的化学反应方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,这两种方案,你认为哪一种方案比较合理?②.(答编号),理由是无污染物产生,节约原料
(2)实验室采用方案①铜与浓硫酸加热直接反应制取硫酸铜时,会有气体产生,若将产生的气体通入盛有品红溶液的试管中,现象是品红溶液褪色;若将Cl2通入品红溶液中也能看到同样的现象,如果不从气体颜色上去判断,到底是SO2还是Cl2导致了上述现象的发生,应怎样操作才能做出判断:对褪色的溶液加热,若恢复红色则是二氧化硫的漂白性,若加热不能恢复溶液颜色,证明为氯气导致的品红溶液褪色,SO2与下列五种有色溶液作用,均能褪色,其实质相同的是:②③⑤(填序号)
①品红、②酸性KMnO4、③溴水、④滴有酚酞的NaOH溶液⑤淀粉---碘溶液
(3)如果实验所需的浓硫酸是用接触法制取的,现有1.6t 75%的FeS2(杂质不含硫元素)的硫铁矿,理论上能制得98%的浓硫酸质量为2×106 克.
(4)如果将3.2g Cu与足量的浓硫酸在加热条件下充分反应,则被还原的硫酸的物质的量为0.05mol.如果把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的BaCl2溶液,得到沉淀23.3g,则稀释后所得溶液中SO42-的物质的量浓度为2mol/L.把产生的气体全部缓缓通入100mL a mol/L的NaOH溶液中,若反应物均无剩余,则a的取值范围是0.5≤b≤1.
分析 ①铜与浓硫酸加热直接反应,生成二氧化硫,会污染环境,二氧化硫具有漂白性,使品红褪色,且二氧化硫为酸性氧化物;
②由Cu→CuO→CuSO4,不生成有害气体,且消耗酸少,以此来解答.
(1)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应过程中生成污染性气体,方案②无污染性气体生成,原料消耗少;
(2)二氧化硫具有漂白性,可观察到品红褪色,若通入盛有石蕊试液的试管中,看到的现象是溶液变色红色,氯气和水反应生成的次氯酸具有漂白性,可以使品红溶液褪色,二氧化硫与酸性KMnO4、溴水、淀粉碘溶液都发生氧化还原反应,都能使溶液褪色,而与滴有酚酞的NaOH溶液发生复分解反应使溶液褪色,使品红褪色是二氧化硫的漂白性,据此答题;
(3)根据硫元素守恒计算;
(4)根据n=$\frac{m}{M}$计算出铜的物质的量,再结合反应方程式计算出被还原的硫酸的物质的量;23.3g沉淀为硫酸钡,根据n=$\frac{m}{M}$计算出硫酸钡的物质的量,再根据n=$\frac{n}{V}$计算出硫酸根离子的浓度;根据铜的量计算出生成二氧化硫的物质的量,再结合反应生成亚硫酸钠、亚硫酸氢钠分别计算出b的值,从而得出其取值范围.
解答 解:(1)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,因①生成有害气体,②中不生成有害气体,且消耗酸少,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;②;无污染物产生,节约原料;
(2)方案①铜与浓硫酸加热直接反应制取硫酸铜时,会有气体二氧化硫产生,若将产生的气体通入盛有品红溶液的试管中,二氧化硫具有漂白性,可观察到品红褪色,若将Cl2通入品红溶液中也能看到同样的现象,如果不从气体颜色上去判断,可以通过漂白性的可逆性分析设计,对褪色的溶液加热,若恢复红色则是二氧化硫的漂白性,若加热不能恢复溶液颜色,证明为氯气导致的品红溶液褪色,二氧化硫与酸性KMnO4、溴水、淀粉碘溶液都发生氧化还原反应,都能使溶液褪色,而与滴有酚酞的NaOH溶液发生复分解反应使溶液褪色,使品红褪色是二氧化硫的漂白性,故选②③⑤,
故答案为:品红溶液褪色;对褪色的溶液加热,若恢复红色则是二氧化硫的漂白性,若加热不能恢复溶液颜色,证明为氯气导致的品红溶液褪色;②③⑤;
(3)1.6t 75%的FeS2(杂质不含硫元素)的硫铁矿中硫元素的物质的量为(1.6×106×75%÷120)×2mol=2×104mol,根据硫元素守恒可知,硫酸的物质的量也为2×108mol,所以98%的浓硫酸质量为$\frac{2×1{0}^{4}×98}{98%}$g=2×106g,
故答案为:2×106;
(4)Cu与足量的浓硫酸在加热条件下充分反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O,3.2g铜的物质的量为:$\frac{3.2g}{64g/mol}$=0.05mol,反应生成二氧化硫为0.05mol,而浓硫酸被还原生成二氧化硫,则被还原的硫酸的物质的量为0.05mol,23.3g硫酸钡的物质的量为:$\frac{23.3g}{233g/mol}$=0.1mol,则稀释后溶液中硫酸根离子的物质的量为0.1mol,其浓度为:$\frac{0.1mol}{0.05L}$=2mol/L,3.2g铜的物质的量为:$\frac{3.2g}{64g/mol}$=0.05mol,根据反应方程式可知,0.05mol铜完全反应生成0.05mol二氧化硫,100mL amol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:amol/L×0.1L=0.1amol,当氢氧化钠与二氧化硫反应生成亚硫酸钠时,消耗氢氧化钠的物质的量为:0.1amol=0.05mol×2,解得:a=1,当二者反应生成亚硫酸氢钠时,消耗氢氧化钠的物质的量为:0.1amol=0.05mol,解得:a=0.5,所以b的范围为:0.5≤a≤1,
故答案为:0.05mol;2mol/L; 0.5≤b≤1.
点评 本题考查化学实验方案的评价、有关范围讨论的化学计算,题目难度较大,试题知识点较多、计算量较大,充分考查学生的分析、理解能力及化学计算能力,注意掌握讨论法在化学计算中的应用方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO${\;}_{2}^{-}$+H2↑ | |
| B. | 硫酸与氢氧化钠溶液反应:H++OH-═H2O | |
| C. | 大理石与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ |
| A. | Na+、HCO3-、SO42-、Br- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、Na+、CO32- | D. | H+、Na+、S2-、NO3- |
| A. | Cl2+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 | |
| B. | SO2+2H2S═3S↓+2H2O | |
| C. | 8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2 | |
| D. | NH3+HNO3═NH4NO3 |
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
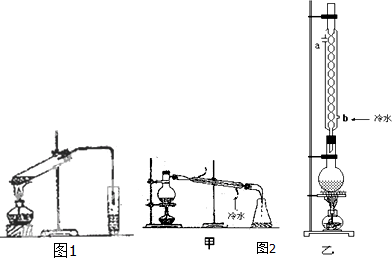
实验室制乙酸乙酯的主要装置如图1所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯.
请同学们回答下列问题:
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓H2SO4的作用是催化剂、吸水剂.
(2)步骤④所观察到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,原因是上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现.
(3)步骤⑤中,分离出乙酸乙酯选用的仪器是分液漏斗.
(4)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如图2甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物).你认为哪种装置合理,为什么?答:乙,反应物能冷凝回流.

Ⅰ.某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成
同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去).A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液.已知常温下浓盐酸与氯酸钾溶液能反应生成氯气.
(1)甲同学设计实验所涉及的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O、SiO32-+CO2+H2O═H2SiO3↓+CO32-;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应.写出该操作中主要离子方程式为2Br-+Cl2?Br2+2Cl-.
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观察到溶液由橙黄色变为蓝色;
(3)根据甲乙同学的实验可得到的结论是:同一主族元素,从上到下,元素的非金属性减弱.
Ⅱ.
| 实验目的 | 探究温度对双氧水分解反应的速率的影响 | ||
| 实验 | 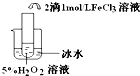 | 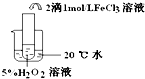 | 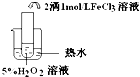 |
| 实验结论 | 结论:温度越高,反应速率越快 FeCl3在实验中的作用为:催化剂 | ||
| 反应方程式 | 2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑ | ||
| A. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| B. | Ba(NO3)2可溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 试管内壁残留的硫酸铁溶液与氢氧化钠溶液反应后产生红褐色固体,可以用盐酸将其溶解. | |
| D. | 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
