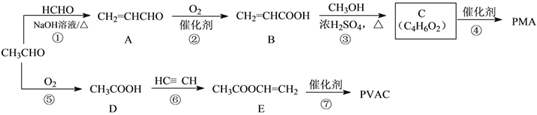��Ŀ����
����Ŀ���±���Ԫ�����ڱ�һ���֣��г��˾���Ԫ�������ڱ��е�λ�ã�
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | �� | |||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� |
���û�ѧ����ش���������
��1��������Ԫ���У���������ǿ����________��
��2���١�����Ԫ������������Ӧ��ˮ������������ǿ����________�������ʻ�ѧʽ����д���͢������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽ________��
��3��ֻ�ɢ��γɵ�18��������________��
��4��д���ڵ����������ĵ���ʽ________��
��5���õ���ʽ��ʾ�ߺ͢��γɵĻ�������γɹ���________��
<>��6������Ԫ�آۺ͢ݿ��γ�һ����Է�������Ϊ66�Ĺ��ۻ�����Y��Y�����и�ԭ�Ӿ��ﵽ��8�����ȶ��ṹ����Y�Ľṹʽ________��
���𰸡� Na HClO4 Al��OH��3��OH����AlO2����2H2O ![]()
![]()
![]() F��N��N��F
F��N��N��F
������������Ԫ�������ڱ��е����λ�ÿ�֪������ֱ���H��C��N��O��F��Na��Mg��Al��Cl����
��1��ͬ�����������ҽ�����������ͬ������ϵ��½����������ߣ����������Ԫ���У���������ǿ����Na����2���ǽ�����Խǿ����ۺ����������Խǿ����ˢ�������Ԫ������������Ӧ��ˮ������������ǿ����HClO4���͢������������Ӧ��ˮ����ֱ����������ƺ��������������߷�Ӧ�����ӷ���ʽΪAl(OH)3��OH����AlO2����2H2O����3��ֻ����Ԫ���γɵ�18��������![]() ����4���ڵ�����������Ƕ�����̼������ʽΪ
����4���ڵ�����������Ƕ�����̼������ʽΪ![]() ����5���ߺ͢��γɵĻ��������Ȼ�þ���������ӻ�������γɹ���Ϊ
����5���ߺ͢��γɵĻ��������Ȼ�þ���������ӻ�������γɹ���Ϊ![]() ����6������Ԫ�آۺ͢ݿ��γ�һ����Է�������Ϊ66�Ĺ��ۻ�����Y��Y�����и�ԭ�Ӿ��ﵽ��8�����ȶ��ṹ������˻�ѧʽΪN2F2���ṹʽΪF��N��N��F��
����6������Ԫ�آۺ͢ݿ��γ�һ����Է�������Ϊ66�Ĺ��ۻ�����Y��Y�����и�ԭ�Ӿ��ﵽ��8�����ȶ��ṹ������˻�ѧʽΪN2F2���ṹʽΪF��N��N��F��

 A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�