题目内容
【题目】(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:

①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区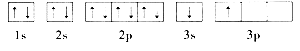
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与![]() 互为等电子体的单质的电子式 。
互为等电子体的单质的电子式 。
③六氰合亚铁离子![]() 中不存在 。
中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
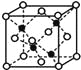
(3)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
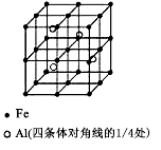
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
【答案】(1) ①能量最低原理 (2分);s (1分)②sp杂化 (1分);直线形 (1分)
(2) ①8 (1分)②![]() (2分)③B (2分)
(2分)③B (2分)
(3) ①Fe2Al (2分) ②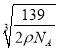 (3分)
(3分)
【解析】
试题分析:(1)①根据能量最低原理,电子总是优先占据能量低的轨道,而该同学所画的电子排布图中3s轨道未排满就去排布3p轨道,所以违背了能量最低原理;根据B的电离能的数据可知,B元素是+2价金属,所以属于第二主族元素,位于元素周期表的s区,为Mg元素;
②根据表中数据可知A也是第二主族元素,因为A、B都是短周期元素,B是Mg,则A只能是Be元素,在BeCl2中,Be的价层电子对数是![]() ,所以Be原子是sp杂化;分子为直线型分子;
,所以Be原子是sp杂化;分子为直线型分子;
(2)①以体心立方堆积形成的金属铁中,其原子的配位数为8;
②CN—中含有2个原子、10个价电子,所以与其互为等电子体的单质中含有2个原子、10个价电子,该分子式是N2,电子式为![]() ;
;
③六氰合亚铁离子[Fe(CN)6]4—中,C与N原子之间是极性共价三键,所以存在σ键 和π键,CN与Fe原子之间是配位键,但不存在非极性键,所以答案选B;
(3)①根据均摊法,该晶胞中Fe原子的个数是8×1/8+6×1/2+12×1/4+1=8,Al原子全部位于体内,共4个Al原子,所以该晶胞中Fe与Al的原子个数比是2:1,其化学式是Fe2Al;
②此合金中最近的两个Fe原子之间的距离为晶胞棱长的一半,设晶胞的棱长为xcm,则4×139/NA/a3=ρ ,所以a=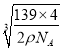 ,则此合金中最近的两个Fe原子之间的距离为a/2=
,则此合金中最近的两个Fe原子之间的距离为a/2=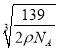 。
。
【考点地位】本题主要是考查晶体判断、核外电子排布、共价键、配位键、晶胞结构和计算等
【名师点晴】金属元素占元素总数的4/5, Fe、Al、Cu是日常生活、生产中用途广、用量大的常见金属。只有认识、了解和掌握金属元素的原子结构、晶体结构和性质,才能更好的发挥金属及合金材料的作用,发挥它的应用范围。通过晶胞中原子个数的计算和金属晶体的密度计算来考查考生的计算能力和应用知识解决问题的能力。考查了学生综合运用所学化学知识解决相关化学问题的能力。本题的解题要点为:掌握物质的性质、元素的原子序数、原子核外电子排布、原子的杂化、晶体的类型、晶体结构、晶体密度的计算方法。然后对各个问题进行逐一解答。难点也恰恰是晶胞的结构分析、判断与计算,注意均摊法和数学知识的迁移灵活应用。