题目内容
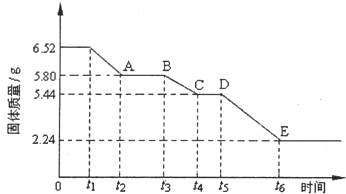
6.孔雀石的主要成分为Cu2(OH)2CO3(难溶),还含少量Fe2O3、SiO2.实验室以孔雀石为原料制备CuCl2•3H2O及CaCO3的步骤如下: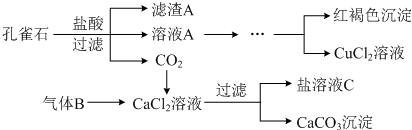
(1)写出孔雀石和盐酸反应的离子方程式Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O.
(2)滤渣A成分的化学式是SiO2,气体B的分子式是NH3.
(3)将CuCl2溶液酸化后,经过加热浓缩、冷却结晶、过滤、洗涤、干燥,得到CuCl2•3H2O晶体.
(4)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下(假设其他成分不发生反应):
a.配制0.1mol•L-1的HCl溶液和0.1mol•L-1的NaOH溶液各250mL.
b.取0.6g磨碎后的胃药于锥形瓶中.
c.向锥形瓶内加入75.00mL 0.1mol•L-1的HCl溶液充分反应.
d.用0.1mol•L-1的NaOH溶液滴定剩余盐酸,至达到滴定终点.
①配制上述NaOH溶液所用到的玻璃仪器除烧杯、玻璃棒外还有胶头滴管、250mL容量瓶.
②若滴定中NaOH溶液的用量为15.00mL,则胃药中碳酸钙的质量分数为50%.
分析 孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物,加入稀盐酸反应后生成二氧化碳气体,得到溶液氯化铜溶、氯化亚铁液A,过滤得到二氧化硅固体;然后将Fe2+氧化成Fe3+,再加入CuO固体调节溶液pH沉淀铁离子过滤得到滤液为氯化铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到氯化铜晶体;由工艺流程转化关系可知,应先向CaCl2溶液中加入碱性物质并且不引入新杂质,故气体X应为碱性气体,应为氨气;
(1)孔雀石和盐酸反应生成氯化铜、二氧化碳和水来解答;
(2)过滤得到二氧化硅固体;向CaCl2溶液中加入碱性物质并且不引入新杂质,故气体为氨气;
(3)由溶液制得晶体,应进行蒸发、冷却结晶、过滤等操作;
(4)②根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
②根据盐酸和氢氧化钠的反应,计算出剩余的盐酸的物质的量,用盐酸总的物质的量减去剩余的盐酸的物质的量,就是碳酸钙消耗的盐酸,再计算出碳酸钙的质量分数即可.
解答 解:(1)孔雀石和稀盐酸反应生成氯化铜、二氧化碳和水,反应的离子方程式为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O;
故答案为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O;
(2)滤渣A成分的化学式是SiO2,气体B的分子式是NH3;
故答案为:SiO2;NH3;
(3)将CuCl2溶液酸化后,经过加热浓缩、冷却结晶、过滤、洗涤、干燥,得到CuCl2•3H2O晶体;
故答案为:加热浓缩;冷却结晶;
(4)①根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有天平、药匙、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故
所用到的玻璃仪器除烧杯、玻璃棒外还有胶头滴管、250 mL容量瓶;
故答案为:胶头滴管、250 mL容量瓶;
②NaOH+HCl=NaCl+H2O
1 1
CaCO3+2HCl=CaCl2+CO2+H2O
1 2
根据上面两个公式可求得于CaCO3反应的HCl物质的量为(75-15)×0.1/1000=0.006mol,CaCO3的物质的量为:0.003mol,质量0.003mol×100g/mol=0.3g,胃药中碳酸钙的质量分数为$\frac{0.3g}{0.6g}$×100%=50%;
故答案为:50%.
点评 本题以化学工艺流程图为载体,设计方案制备CuCl2•3H2O及CaCO3,考查无机化学与实验的融合能力,以及完成基本实验操作的能力和化学计算,难度大.

 阅读快车系列答案
阅读快车系列答案 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)?CH3OH(g)△H1
反应II:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是Ⅰ(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)=0.8mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是d.
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g )═CO2(g )+2H2O(l)△H1=-726.52 kJ/mol.
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下).请根据图示回答下列问题:
①通入甲醇蒸气的电极应为负极(填写“正”或“负”),该电极上发生的电极反应是b(填字母代号).
a.2CH3OH-12e-+3O2═2CO2+4H2O
b.CH3 OH-6e-+8OH-═CO32-+6H2O
c.O2+2H2O+4e-═4OH-
d.O2-4e-+4H+═2H2O
②写出电极A的名称阴极.写出B电极的电极反应式4OH--4e-═O2↑+2H2O.
③当碱性甲醇燃料电池消耗3.36L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是0.45mol.
 ,它不稳定,在水中易发生岐
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
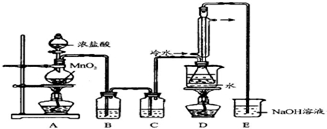
回答下列问题:
(1)写出A装置中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝回流双重作用.这种冷却装置可应用于下列高中化学中ACD实验.
A.石油分馏 B.制备乙烯 C.制取乙酸乙酷 D.制取溴苯
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,拆除装置时,应先将E中长导管移开液面,目的是防止倒吸.
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O.(用离子方程式表示)
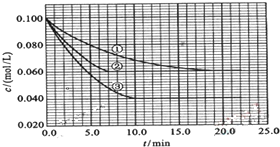 浓度为0.06mol/L.
浓度为0.06mol/L.
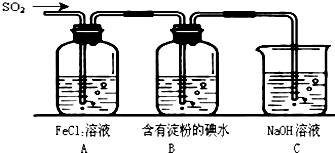 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: