题目内容
【题目】德国化学家韦尔斯泰特,经过10年的艰苦努力,韦尔斯泰特用成吨的绿叶,终于提取到了绿叶中的神秘物质——叶绿素,正是因为叶绿素在植物体内所起到的奇特作用,才使我们人类得以生存。可以说,没有光合作用就没有人类的生存和发展。由于成功地提取了叶绿素,1915年,韦尔斯泰特荣获了诺贝尔化学奖。叶绿素的结构如图
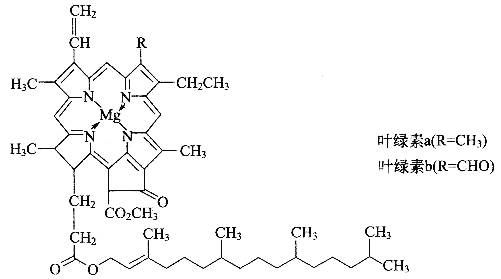
(1)光合作用产生氧气,氧气的一种同素异形体O3,在高空能吸收大量紫外线,保护地球上的人类和动植物免遭短波紫外线的伤害。请写出一种短周期元素形成的O3等电子体分子________,该分子的空间构型为________,中心原子的杂化类型是_________。
(2)镁是叶绿素中的重要组成元素,镁的基态原子价电子排布式为__________,叶绿素中镁形成的化学键类型有___________________。叶绿素不易溶于水,而溶于有机溶剂,如乙醇、丙酮、乙醚、氯仿等,是因为______________________________。
(3)叶绿素构成元素中,又属于二周期元素中,第一电离能由大到小的顺序(请用元素符号表示):_______________,理由是______________________________。
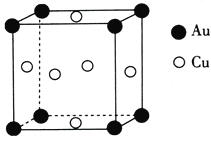
(4)叶绿素的构成元素中,H和Mg属于第一、三周期的元素,能形成一种离子型储氢材料,晶体结构如图所示:
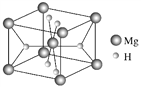
则 该晶体的化学式为__________________,已知该晶体的密度为ρ g·cm-3,晶胞的体积为________ cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
【答案】 SO2 V形 SP2杂化 3S2 配位键和极性共价键 叶绿素为有机物根据相似相溶原理易溶于有机溶剂不易溶于水 N>O>C 同周期原子序数增大,第一电离能增大,N原子的2p能级达到半满的稳定结构,所以导致其第一电离能反常增大。 MgH2 ![]() cm3
cm3
【解析】(1)等电子体的要求是原子个数相等,价电子总数也相等,所以书写等电子体的较好方法是将原子替换为同主族原子。根据以上原则,O3的等电子体比较好判断的就是SO2。根据价层电子对互斥理论,SO2的中心原子S的价电子对数为2+![]() 对,三个电子对应该是平面三角,但是又一个孤电子对,所以可以判断出SO2为V形结构,中心原子S的杂化类型应该是sp2杂化。
对,三个电子对应该是平面三角,但是又一个孤电子对,所以可以判断出SO2为V形结构,中心原子S的杂化类型应该是sp2杂化。
(2)镁是第12号元素,原子核外有12个电子,其价电子为最外层(M层)上的两个电子,所以其价电子基态排布式为:3s2。从图中可以看出Mg和左上、右下的氮原子形成共价键,和左下、右上的氮原子形成配位键(画的是箭头)。叶绿素是有机物,分子的极性相对较小,根据相似相溶原理,应该易溶于有机溶剂。
(3)叶绿素构成元素中,又属于二周期元素的是C、N、O。同周期元素由左向右第一电离能应该逐渐增大,但是N原子具有p能级的半满稳定结构,所以第一电离能大于O。所以顺序为:N>O>C。
(4)晶胞内Mg为8×![]() ,H为4×
,H为4×![]() ,所以晶体的组成为MgH2。1个晶胞中有2个MgH2,其质量为
,所以晶体的组成为MgH2。1个晶胞中有2个MgH2,其质量为![]() g。所以晶胞的体积为
g。所以晶胞的体积为![]() cm3。
cm3。

【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1