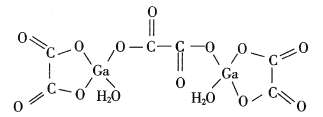
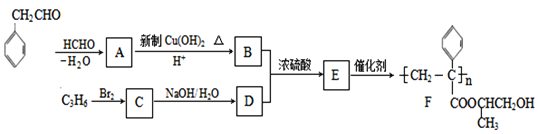
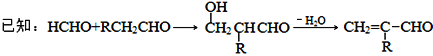
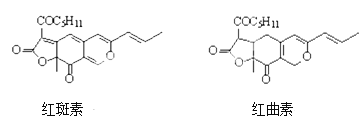
题目内容
【题目】25 ℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是
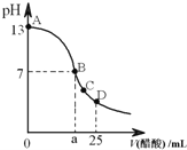
A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.用含a的代数式表示CH3COOH的电离常数K=![]()
C.C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-)
【答案】BD
【解析】
A. 在靠近A点的溶液:c(Na+)>c(OH-))>c(CH3COO-) >c(H+),A错误;
B. 从B点分析,c(CH3COOH)=(0.2a-25×0.1)×10-3mol,n(CH3COO-)= n(Na+)=2.5×10-3mol,c(H+)=10-7mol,K=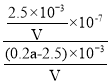 =
=![]() ,B正确;
,B正确;
C. C点对应的溶液中,以过量醋酸的电离为主,水的电离受到抑制,由水电离出的H+浓度小于10-7 mol·L-1,C错误;
D. D点对应的反应后的溶液中,n(CH3COO-)= n(CH3COOH),然后发生电离,
从而存在如下关系:CH3COOH![]() CH3COO-+H+,H2O
CH3COO-+H+,H2O![]() H++OH-
H++OH-
c(CH3COO-)- [c(H+)-c(OH-)]= c(CH3COOH)+ [c(H+)-c(OH-)]
从而得出c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-),D正确。
故选BD。

 互动英语系列答案
互动英语系列答案【题目】X、Y、 Z三种可溶性盐,其阳离子分别是Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种。现做以下实验:
①将三种盐各取少量,分别溶于盛有5 mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2 mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
(1)根据上述事实,推断这三种盐的化学式:X______,Y______,Z______。
(2)若上述三种阳离子Ba2+、Cu2+、Ag+对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下:

部分物质溶解性表为
Ba2+ | Cu2+ | Ag+ | |
Cl- | 溶 | 溶 | 不 |
CO32- | 不 | 不 | 不 |
SO42- | 不 | 溶 | 微 |
S2- | 溶 | 不 | 不 |
①沉淀1的化学式为_________________。
②写出混合溶液与试剂A反应的离子方程式:______________。
③若C为Na2S,且它与B的阳离子相同,则试剂B的名称是____________。