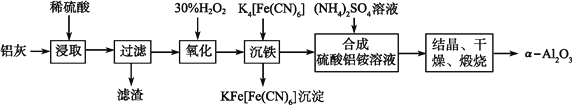
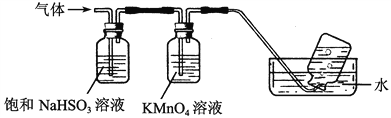
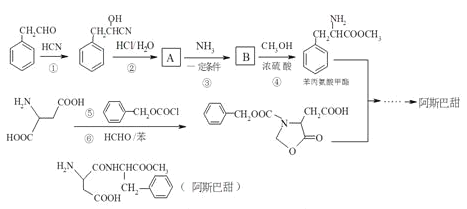
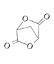
题目内容
【题目】下列叙述正确的是
A.杂化轨道只用于形成![]() 键或用于容纳未参与成键的孤电子对
键或用于容纳未参与成键的孤电子对
B.凡是中心原子采取![]() 杂化轨道成键的分子,其几何构型都是正四面体形
杂化轨道成键的分子,其几何构型都是正四面体形
C.CH2=CH2分子中共有四个σ键和一个π键
D.若把H2S分子写成H3S分子,违背了共价键的方向性
【答案】A
【解析】
A.杂化轨道只用于形成![]() 键或用于容纳未参与成键的孤电子对,故A正确;
键或用于容纳未参与成键的孤电子对,故A正确;
B.凡是中心原子采取![]() 杂化轨道成键的分子,其几何构型不一定是正四面体形,可能是三角锥形,如氨分子,也可能是V形,如水,也可能是直线形,如氟化氢,故B错误;
杂化轨道成键的分子,其几何构型不一定是正四面体形,可能是三角锥形,如氨分子,也可能是V形,如水,也可能是直线形,如氟化氢,故B错误;
C.CH2=CH2分子中共有五个σ键(4个C-H键,1个C-C键)和一个π键,故C错误;
D.若把H2S分子写成H3S分子,违背了共价键的饱和性,故D错误;
故选A。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目