题目内容
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是
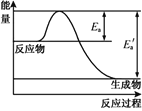
A.Ea为逆反应活化能,E为正反应活化能
B.该反应为放热反应,ΔH=Ea’-Ea
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
【答案】D
【解析】
由图可知,反应物的总能量大于生成物的总能量,该反应为放热反应。
A项、由图可知, Ea为正反应活化能,E为逆反应活化能,故A错误;
B项、由图可知,反应物的总能量大于生成物的总能量,该反应为放热反应,反应热ΔH=—(Ea’-Ea),故B错误;
C项、在相同温度下,分子的能量并不完全相同,有些分子的能量高于分子的平均能量,称为活化分子,则所有活化分子的平均能量高于所有分子的平均能量,故C错误;
D项、该反应为放热反应,逆反应速率加快幅度大于正反应加快幅度,使平衡向吸热的逆反应方向移动,故D正确;
故选D。

【题目】某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验。
| 实验 | 条件 | 现象 |
ⅰ | 18℃ | 无明显气泡,0.5 min后有气体产生,一段时间后,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 | |
ⅱ | 65℃水浴 | 有气泡产生,12 s后,气泡非常明显,溶液很快转为红棕色,一段时间后,红棕色消失,最后产生红棕色沉淀 |
(1)实验ⅰ和ⅱ中均有气体产生,该气体为 ________。
(2)实验ⅱ中产生气体的速率明显快于实验ⅰ,可能的原因是________。
(3)“加铁氰化钾溶液有蓝色沉淀生成”说明混合溶液中存在________。
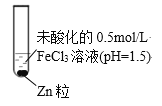
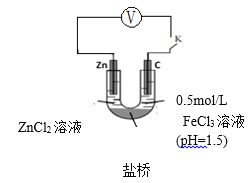
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化。研究小组猜想,可能是此实验条件下,氧化性H+>Fe3+。
查阅资料:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。根据资料小组同学设计了如下对比实验。
实验ⅲ | 实验ⅳ |
| _____________ |
①请在表格中画出实验ⅳ的装置图 。
②进行对比实验,观察到________,得出氧化性:Fe3+>H+。
研究小组进一步分析后,将Zn粒改为Zn粉,继续进行实验。
实验 | 条件 | 现象 |
ⅴ | 18℃,混合后不振荡 | 3 min后有明显的气泡产生,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
ⅵ | 18℃,混合后振荡 | 气泡不明显,红棕色褪色明显,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
③对比实验ⅴ和ⅵ,解释“气泡不明显,红棕色褪色明显”的可能原因:________。
(5)结合实验探究过程及现象,影响Zn与FeCl3溶液的反应过程的条件有________。