题目内容
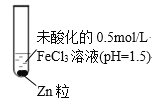
【题目】某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验。
| 实验 | 条件 | 现象 |
ⅰ | 18℃ | 无明显气泡,0.5 min后有气体产生,一段时间后,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 | |
ⅱ | 65℃水浴 | 有气泡产生,12 s后,气泡非常明显,溶液很快转为红棕色,一段时间后,红棕色消失,最后产生红棕色沉淀 |
(1)实验ⅰ和ⅱ中均有气体产生,该气体为 ________。
(2)实验ⅱ中产生气体的速率明显快于实验ⅰ,可能的原因是________。
(3)“加铁氰化钾溶液有蓝色沉淀生成”说明混合溶液中存在________。
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化。研究小组猜想,可能是此实验条件下,氧化性H+>Fe3+。
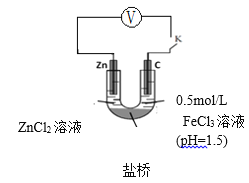
查阅资料:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。根据资料小组同学设计了如下对比实验。
实验ⅲ | 实验ⅳ |
| _____________ |
①请在表格中画出实验ⅳ的装置图 。
②进行对比实验,观察到________,得出氧化性:Fe3+>H+。
研究小组进一步分析后,将Zn粒改为Zn粉,继续进行实验。
实验 | 条件 | 现象 |
ⅴ | 18℃,混合后不振荡 | 3 min后有明显的气泡产生,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
ⅵ | 18℃,混合后振荡 | 气泡不明显,红棕色褪色明显,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
③对比实验ⅴ和ⅵ,解释“气泡不明显,红棕色褪色明显”的可能原因:________。
(5)结合实验探究过程及现象,影响Zn与FeCl3溶液的反应过程的条件有________。
【答案】H2 温度升高,使Fe3++3H2O![]() Fe(OH)3+3H+正向移动,c(H+)增大,c(H+)增大和升高温度都会使锌与H+反应的速率加快 Fe2+
Fe(OH)3+3H+正向移动,c(H+)增大,c(H+)增大和升高温度都会使锌与H+反应的速率加快 Fe2+ 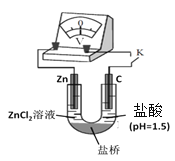 电压表指针偏转:实验ⅲ>实验ⅳ 将Zn粒改为Zn粉并振荡,增大了Zn与Fe3+碰撞几率,加快了Zn与Fe3+的反应 温度、碰撞几率(离子迁移速度)、粒子的氧化性强弱
电压表指针偏转:实验ⅲ>实验ⅳ 将Zn粒改为Zn粉并振荡,增大了Zn与Fe3+碰撞几率,加快了Zn与Fe3+的反应 温度、碰撞几率(离子迁移速度)、粒子的氧化性强弱
【解析】
(1)Zn是比较活泼的金属,与酸性溶液中的H+发生置换反应产生H2;
(2)依据化学反应速率的影响因素分析;
(3)铁氰化钾遇Fe2+会形成蓝色沉淀;
(4)①要比较Fe3+、H+的氧化性,应该只有氧化性的微粒不同,其它条件都相同;
②根据题干条件:物质氧化性与还原性强弱差异越大,电压越大进行分析;
③对比分析颗粒大小、接触面积对Zn与Fe3+反应的影响;
(5)对前面实验情况分析对比,找到影响反应的因素。
(1)Fe3+发生水解使溶液的pH=1.5,Zn是比较活泼的金属,能够与溶液中的H+发生置换反应:Zn+2H+=Zn2++H2↑,反应产生氢气,因此有气泡产生;
(2)实验ii的温度比实验i高,升高温度,化学反应速率加快;且FeCl3是强酸弱碱盐,在溶液中存在盐的水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,温度升高,使水解平衡正向移动,导致溶液中c(H+)增大,c(H+)增大也会使锌与H+反应的速率加快;
Fe(OH)3+3H+,温度升高,使水解平衡正向移动,导致溶液中c(H+)增大,c(H+)增大也会使锌与H+反应的速率加快;
(3)向i反应混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成,说明溶液中含有Fe2+;
(4)①分析比较H+、Fe3+的氧化性,应该在其它外界条件都相同,只有Fe3+、H+微粒种类的不同的条件下进行,因此设计的对比实验是将pH=1.5的0.5mol/LFeCl3溶液换成pH=1.5的盐酸,装置图为: 。
。
②电压大小反映了物质氧化还原性强弱的差异。物质氧化性与还原性强弱差异越大,电压越大,若在实验过程中观察到现象为:电压表指针偏转:实验ⅲ>实验ⅳ,则证明了微粒的氧化性:Fe3+>H+;
③振荡后,气泡不明显,溶液红棕色褪色明显,说明将Zn粒改为Zn粉并振荡,增大了Zn与Fe3+碰撞几率,加快了Zn与Fe3+的反应,使反应速率大大加快;
(5)通过对上述几个实验过程的探究及对实验现象的观察,可知影响Zn与FeCl3溶液的反应过程的条件有:温度、碰撞几率(离子迁移速度)、粒子的氧化性强弱。

 高中必刷题系列答案
高中必刷题系列答案