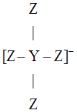题目内容
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
(1)常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+ c(H+)=c(OH-)+ c(CH3COO-)
(2)对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
(3)常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
(4)常温下,已知酯酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh:水的离子积为Kw:则有:Ka·Kh=Kw
(5)电解精炼铜时,电解质溶液中铜离子浓度不变
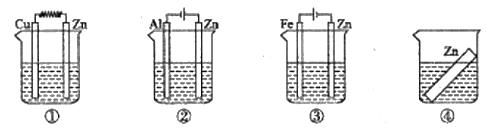
(6)如图装置中都盛有0.1mol/L的NaCl溶液,放置一段时间后,装置中的四块相同的锌片腐蚀速率由大到小的正确顺序是②①④③
A.(1)(4)(6)
B.(1)(2)(4)(6)
C.(2)(4)(5)
D.(2)(3)(4)(6)
【答案】A
【解析】
(1) pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,溶液中的溶质为醋酸钠和醋酸,依据电荷守恒原理可得:c(Na+)+ c(H+)=c(OH-)+ c(CH3COO-),(1)正确;
(2)增大反应物浓度,平衡正向移动,生成物的物质的量增大,但百分含量不一定增大,(2)不正确;
(3)常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度不相同,在前者中溶解度小,(3)不正确;
(4)常温下,已知醋酸电离平衡常数为Ka=![]() ;醋酸根水解平衡常数为Kh=
;醋酸根水解平衡常数为Kh=![]() ,水的离子积为Kw= c(H+)c(OH-):则有:Ka·Kh=
,水的离子积为Kw= c(H+)c(OH-):则有:Ka·Kh=![]() ×
×![]() = c(H+)c(OH-)=Kw,(4)正确;
= c(H+)c(OH-)=Kw,(4)正确;
(5)电解精炼铜时,阳极Ni、Fe、Cu等失电子,阴极Cu2+得电子,电解质溶液中铜离子浓度减小,(5)不正确;
(6)装置中:①锌为原电池负极,加速腐蚀;②锌为电解池阳极,腐蚀速率比①还快;③锌为电解池阴极,得到保护;④锌为通常情况下的腐蚀。从而得出四块相同的锌片腐蚀速率由大到小的正确顺序是②①④③,(6)正确;
综合以上分析,(1)(4)(6)正确,故选A。