题目内容
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
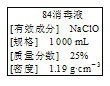
(1)该“84消毒液”的物质的量浓度约为___ mol·L-1。(取整数)
(2)某同学取100 mL 该“84消毒液”,稀释100倍后用于消毒,稀释后的溶液中c(Na+)=_____ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是____(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
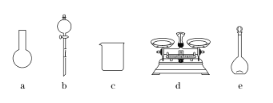
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
【答案】4.0 0.04 C
【解析】
(1)根据c=![]() 计算;
计算;
(2)根据稀释前后溶质的物质的量不变来计算;
(3)根据溶液的配制及c=![]() 、m=nM来分析判断。
、m=nM来分析判断。
(1)c(NaClO)=c=![]() =
=![]() =4.0 molL-1,故答案为:4.0;
=4.0 molL-1,故答案为:4.0;
(2)稀释后c(NaClO)=![]() ×4.0 molL-1=0.04 molL-1,c(Na+)=c(NaClO)=0.04 molL-1,故答案为:0.04;
×4.0 molL-1=0.04 molL-1,c(Na+)=c(NaClO)=0.04 molL-1,故答案为:0.04;
(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来配制和定容,图示的A、B两种仪器不需要,还需玻璃棒和胶头滴管两种玻璃仪器,故A错误;B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,一部分NaClO残留在烧杯中,导致NaClO偏少,溶液浓度偏低,故C正确;D.含NaClO质量分数为25%的消毒液的物质的量浓度为4.0 molL-1,应选取500 mL的容量瓶进行配制,所以需要NaClO的质量:0.5 L×4.0 molL-1×74.5 gmol-1=149 g,故D错误;故答案为:C。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案