题目内容
【题目】某固体粉末由Na2O与Na2O2组成,将其分成等量的二份,一份与足量的CO2气体作用,发现该固体质量增加了10.0g,同时生成了新的气体A;另一份溶于过量的盐酸后,经蒸发结晶,最后得到固体的质量为35.1g,试计算:
(1)A气体在标况下的体积是_____________L
(2)固体中Na2O与Na2O2的物质的量之比是___________:
【答案】2.24 1:2
【解析】
⑴设一份中Na2O2、Na2O物质的量依次为xmol、ymol

![]() =
=![]() =
=![]() ,解得a=28x,c=11.2x
,解得a=28x,c=11.2x
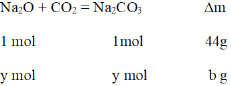
![]() =
=![]() ,解得b=44y
,解得b=44y
a+ b = 10.0即28x+44y=10.0
再根据钠守恒关系得出(2x + 2y)mol × 58.5 gmol-1 = 35.1g
解得x = 0.2 ,y = 0.1
则气体A在标况下的体积为11.2×0.2L=2.24L,故答案为2.24 L;
⑵根据分析得出固体中Na2O与Na2O2的物质的量之比是1:2,故答案为1:2。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目