题目内容
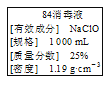
【题目】实验室需要750 mL 0.16 mol·L-1的NaCl溶液,有如下操作步骤:
A. 把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解,冷却至室温
B. 继续向容量瓶中加蒸馏水至液面距刻度线以下1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
C. 用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶
D. 把A所得溶液小心转入一定容积的容量瓶中
E. 将容量瓶瓶塞塞紧,充分摇匀
请填写下列空白:
(1)简述容量瓶使用前必须进行的操作________________________________
(2)操作步骤的顺序为____________________(填序号)。
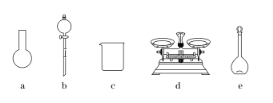
(3)实验室有如下规格的容量瓶:a.100 mL,B. 250 mL,C. 500 mL,d. 1000 mL,本实验选用__________(填序号)。
(4)本实验用到的基本实验仪器除容量瓶、药匙、玻璃棒、烧杯、量筒、胶头滴管外,还必须用到的仪器有____________,实验中玻璃棒的作用是_________________。
(5)本实验需用托盘天平称取NaCl晶体的质量是___________g。
(6)误差分析(填“偏高”“偏低”或“无影响”):
A. 某同学试验时未洗涤烧杯:____________。
B. 某同学观察液面的情况如图所示:____________。

C. 称取的食盐中混有Na2CO3杂质:___________。
(7) 已知所得溶液密度为1.04 g/mL,则所得溶液的质量分数为:___________
【答案】检查是否漏水 A→D→C→B→E d 托盘天平(带砝码) 搅拌加速溶解、引流 9.4 偏低 偏低 偏低 0.9%
【解析】
(1)、容量瓶在使用前需要检漏;
(2)、配置溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、装瓶;
(3)、根据大而近的原则选取;
(4)、根据溶液配置过程选取;
(5)、根据m=cVM,称量;
(6)、根据公式![]() 进行分析;
进行分析;
(7)、根据公式![]() 进行计算。
进行计算。
(1)、容量瓶在使用前需要检验是否漏水,故答案为:检查是否漏水;
(2)、配置溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,故答案为:A→D→C→B→E;
(3)、根据大而近的原则选取,需要配置750mL的溶液需要选取1000mL的容量瓶,故答案为d;
(4)、根据溶液配置过程还需要选取托盘天平(带砝码),玻璃棒的作用:在溶解时搅拌,加速溶解,在转移和洗涤时引流,故答案为:托盘天平(带砝码);搅拌加速溶解、引流;
(5)、根据m=cVM计算需要称量的质量为:![]() ,故答案为:9.4g;
,故答案为:9.4g;
(6)、A、未洗涤烧杯导致溶质未完全转移到容量瓶,根据公式![]() 进行分析可知导致浓度偏低,故答案为:偏低;
进行分析可知导致浓度偏低,故答案为:偏低;
B、定容时仰视刻度导致溶液体积偏大,根据公式![]() 进行分析可知导致浓度偏低,故答案为:偏低;
进行分析可知导致浓度偏低,故答案为:偏低;
C、称取的食盐中混有Na2CO3杂质导致NaCl的物质的量减少,根据公式![]() 进行分析可知导致浓度偏低,故答案为:偏低;
进行分析可知导致浓度偏低,故答案为:偏低;
(7)、根据公式![]() 可知:
可知:![]() ,故答案为0.9%。
,故答案为0.9%。