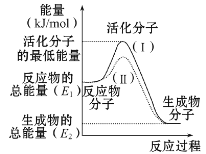
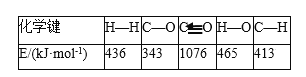
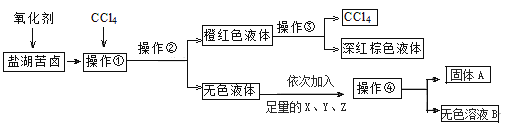
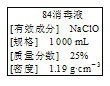
题目内容
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素 CO(NH2)2,原理如图。下列有关说法正确的是
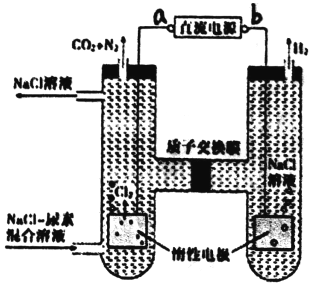
A. a为电源的负极
B. 电解前后,阴极室溶液的pH不变
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44L,则除去的尿素为7.2g(忽略气体的溶解)
【答案】B
【解析】
A.由图可知,左室电极产物为CO2和N2,发生氧化反应,故a为电源的正极,右室电解产物H2,发生还原反应,故b为电源的负极,故A错误;
B.阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑),阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变,故B正确;
C.由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl--2e-═Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,故C错误;
D.题中没有说明收集到的气体是否在标准状况下,无法使用气体摩尔体积进行计算,故D错误。
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目