题目内容
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 啤酒和饮料中常溶有X的最高价氧化物,打开瓶子时,这种氧化物会大量逸出 |
| Y | Y2是空气中含量最高的气体单质 |
| Z | Z的基态原子最外层电子排布式为2s22p4 |
| W | W的一种核素质量数为27,中子数为14 |
(1)W位于元素周期表第 周期第 族;Z和W的最简单的离子半径大小关系为
(用离子符号表示)
(2)一种X形成的单质,是自然界硬度最大的物质,若熔化这种单质,所需克服的微粒间的作用力是 ;Y的电负性比Z (填“大”或“小”)
(3)W的单质与NaOH溶液反应的离子方程式为 , W在高温条件下可还原高熔点的金属氧化物制的金属单质,写出W还原Cr2O3反应的化学方程式: 。
(4)煤燃烧产生的烟气中有Y的氧化物,会引起严重的环境问题,因此,常用XH4催化还原以消除污染,已知:
XH4(g)+2 YO2(g)="=" Y2(g)+ XO2(g)+2H2O (g) △H1= -867kJ/mol
2 YO2(g)
 Y2O4(g) △H2=-56.9kJ/mol
Y2O4(g) △H2=-56.9kJ/mol
(1)3 ⅢA (每空1分) r(O2-)>r(Al3+)(1分)
(2)共价键 小(每空1分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分) Cr2O3+2Al 2Cr+Al2O3(2分)
2Cr+Al2O3(2分)
(4)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1KJ/mol(2分)
解析试题分析:根据表格中信息,可推出X、Y、Z、W分别是C、N、O、Al。
(1)Al位于第3周期第ⅢA 族 ;半径关系为r(O2-)>r(Al3+)
(2)金刚石中的化学键为共价键;同周期从左往右,电负性增大。
(3)根据题意:2Al+2OH-+2H2O=2AlO2-+3H2↑; Cr2O3+2Al 2Cr+Al2O3
2Cr+Al2O3
(4)问根据盖斯定律,将①式减去②式即可得到答案。
考点:利用元素推断考查元素周期表(律)、原子结构、电负性、化学键及盖斯定律知识。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
短周期元素W、X、Y、Z的原子序数依次增大,下列相关比较错误的是
| A.稳定性:H2X H2Z | B.酸性:H2ZO3<H2ZO4 |
| C.还原性:W-<Z2- | D.半径:Y3+<Z2- |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
| A.原子半径的大小顺序: r(Y)>r(Z)>r(W) |
| B.元素Z、W 的简单离子的电子层结构不同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是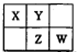
| A.元素X和元素W最高正价代数和一定为8 |
| B.若元素X的原子序数为a,则Z的原子序数一定为a+9 |
| C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 |
| D.原子半径的大小顺序为:rW>rZ>rX>rY |
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,它们的部分化合价如下表。下列说法正确的是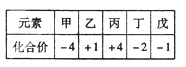
| A.乙的单质中能与水剧烈反应 |
| B.气态氢化物的稳定性:丙>甲 |
| C.丙的氧化物能与戊的氢化物水溶液反应 |
| D.其最高价氧化物对应的水化物的酸性:丁>戊 |
有X、Y、Z、M四种短周期元素,其中X、Y、Z同周期。Z、M同主族,X2+与M2-具有相同的电子层结构;Y的单质常用做电脑的芯片材料。下列说法中正确的是
| A.元素Y的最高价氧化物属于两性氧化物 |
| B.元素M的某种单质可作水处理的消毒剂 |
| C.X、M两种元素形成的化合物中只可能含离子键 |
| D.Y、Z、M三种元素的气态氢化物的热稳定性依次减弱 |