题目内容
9.下列措施中,能加快化学反应速率的是( )| A. | 食物储存在冰箱里 | |
| B. | 向H2O2溶液中加入MnO2 | |
| C. | 用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 | |
| D. | 用0.1 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应 |
分析 加快反应速率,可升高温度、增大浓度、压强、增大故体表面积或加入催化剂等,以此解答该题.
解答 解:A、将食物储存在冰箱里,降低温度可以减慢反应速率,故A错误;
B、往H2O2溶液中加入少量MnO2,MnO2作催化剂,可以加快化学反应速率,故B正确;
C、块状碳酸钙代替粉末状碳酸钙,减小了固体的表面积,反应速率减慢,故C错误;
D、用0.1 mol/L H2SO4溶液代替1 mol/L H2SO4溶液,氢离子浓度减小,所以与锌粒反应速率减慢,故D错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
20.欲制取较纯净的1,2二氯乙烷,可采取的方法是( )
| A. | 乙烯与HCl加成 | |
| B. | 乙烯与Cl2加成 | |
| C. | 乙烷与Cl2按1:2的体积比在光照条件下反应 | |
| D. | 乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应 |
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 mol 的2H35Cl分子中的中子数是2NA | |
| B. | 1 mol乙醇所含的羟基的电子数是9NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 将2.24 L(标准状况下)CO2通入1 L 0.15 mol•L-1的NaOH溶液中,所得CO32-和HCO3-物质的量均为0.05mol |
4.由碘乙烷制取乙二醇,依次发生反应的类型是( )
| A. | 取代、加成、水解 | B. | 消去、加成、取代 | C. | 水解、消去、加成 | D. | 消去、水解、取代 |
14.下列化学用语的表达正确的是( )
| A. | Na2SO4电离:Na2SO4=Na2++SO42- | |
| B. | 氯化钠的分子式:NaCl | |
| C. | 质子数为6,中子数为8的微粒:${\;}_{6}^{8}$C | |
| D. | 医用“钡餐”的化学式:BaSO4 |
7.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 除去瓷器表面污垢可以选用热的烧碱溶液 | |
| B. | 溶质质量分数:医用酒精>食醋>生理盐水 | |
| C. | 绚丽缤纷的烟花是因添加了钾、钠、钙、铜等金属元素的焰色反应形成的 | |
| D. | 研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
4.乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
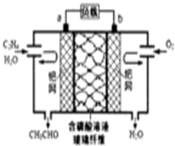

| A. | 每有0.1molO2反应,则迁移H+0.4mol | |
| B. | 该电池为可充电电池 | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 正极反应式为:CH2=CH2-2e-+2OH→CH3CHO+H2O |