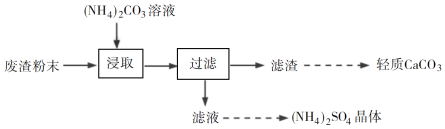
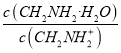题目内容
【题目】非金属元素在化学中具有重要地位,请回答下列问题:
(1)氧元素的第一电离能比同周期的相邻元素要小,理由________。
(2)元素X与硒(Se)同周期,且该周期中X元素原子核外未成对电子数最多,则X为_____(填元素符号),其基态原子的电子排布式为_______。
(3)臭齅排放的臭气主要成分为3-MBT-甲基2丁烯硫醇,结构简式为(![]() )1mol 3-MBT中含有
)1mol 3-MBT中含有![]() 键数目为_______NA(NA为阿伏伽德罗常数的值)。该物质沸点低于(CH3)2C=CHCH2OH,主要原因是_______。
键数目为_______NA(NA为阿伏伽德罗常数的值)。该物质沸点低于(CH3)2C=CHCH2OH,主要原因是_______。
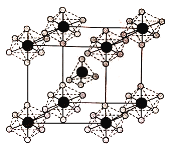
(4)PCl5是一种白色晶体,熔融时形成一种能导电的液体测得其中含有一种正四面体形阳离子和一种正八面体形阴离子;熔体中P-Cl的键长只有198pm和206pm两种,试用电离方程式解释PCl5熔体能导电的原因_________,正四面体形阳离子中键角大于PCl3的键角原因为__________,该晶体的晶胞如图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_______g/cm 3
【答案】F对最外层电子的吸引力比O强,N原子核外电子处于半满的较稳定状态,故第一电离能均高于O Cr 1s22s22p63s23p63d54s1或[Ar]3d54s1 15 (CH3)2C=CHCH2OH分子间含有氢键,增大分子间的作用力,使沸点升高 2 PCl5 = PCl4++PCl6- PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对。孤电子对对成键电子的排斥力大于成键电子对间的排斥力 ![]() 或
或![]()
【解析】
(1)F对最外层电子的吸引力比O强,N原子核外电子处于半满的较稳定状态;
(2)元素X与(Se)同周期,且该周期中X元素原子核外未成对电子数最多,X应该是第四周期3d、4s能级半满的原子,为24号元素;该原子核外有24个电子,根据构造原理书写其基态原子的电子排布式;
(3)臭齅排放的臭气主要成分为3-MBT-甲基2丁烯硫醇,结构简式为![]() ),共价单键为σ键、共价双键中一个是σ键另一个是排键,所以1个3-MBT分子中含有15个σ键;存在分子间氢键的物质熔沸点较高;
),共价单键为σ键、共价双键中一个是σ键另一个是排键,所以1个3-MBT分子中含有15个σ键;存在分子间氢键的物质熔沸点较高;
(4)含有自由移动离子的化合物能导电;孤电子对对成键电子的排斥力大于成键电子对间的排斥力;该晶胞中PCl5个数=1+8×![]() =2,晶胞体积=(a×10-10cm)3,晶胞密度=
=2,晶胞体积=(a×10-10cm)3,晶胞密度=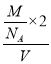 。
。
(1)F对最外层电子的吸引力比O强,N原子核外电子处于半满的较稳定状态,所以第一电离能均高于O元素
(2)元素X与(Se)同周期,且该周期中X元素原子核外未成对电子数最多,X应该是第四周期3d、4s能级半满的原子,为24号元素;该原子核外有24个电子,根据构造原理书写其基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1;
(3)臭齅排放的臭气主要成分为3-MBT-甲基2丁烯硫醇,结构简式为![]() ),共价单键为σ键、共价双键中一个是σ键另一个是Π键,所以1个3-MBT分子中含有15个σ键,则1mol该分子中含有15NA个σ键;(CH3)2C=CHCH2OH分子间含有氢键,增大分子间的作用力,使沸点升高;
),共价单键为σ键、共价双键中一个是σ键另一个是Π键,所以1个3-MBT分子中含有15个σ键,则1mol该分子中含有15NA个σ键;(CH3)2C=CHCH2OH分子间含有氢键,增大分子间的作用力,使沸点升高;
(4)含有自由移动离子的化合物能导电,PCl5是一种白色晶体,熔融时形成一种能导电的液体测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,阳离子、阴离子分别为PCl4+、PCl6-,其电离方程式为2PCl5 ![]() PCl4++PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以正四面体形阳离子中键角大于PCl3的键角;该晶胞中PCl5个数=1+8×
PCl4++PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以正四面体形阳离子中键角大于PCl3的键角;该晶胞中PCl5个数=1+8×![]() =2,晶胞体积=(a×10-10cm)3,晶胞密度=
=2,晶胞体积=(a×10-10cm)3,晶胞密度=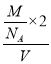 =
=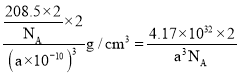 g/cm3。
g/cm3。