题目内容
【题目】某温度下,恒容密闭容器内发生反应:H2(g)+I2 (g) ![]() HI(g) Δ H< 0,该温度下, K=43。某时刻,测得容器内 H2、I2、HI 的浓度依次为 0.01 mol/L、0.01mol/L、0.02mol/L。 一段时间后,下列情况与事实相符的是
HI(g) Δ H< 0,该温度下, K=43。某时刻,测得容器内 H2、I2、HI 的浓度依次为 0.01 mol/L、0.01mol/L、0.02mol/L。 一段时间后,下列情况与事实相符的是
A.氢气的体积分数变小B.混合气体密度变大
C.混合气体颜色变深D.容器内压强变小
【答案】A
【解析】
某时刻,测得容器内H2、I2、HI的浓度依次为0.01 mol/L、0.01mol/L、0.02mol/L,则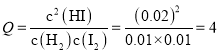 <43,即Q<K,所以平衡会正向移动。
<43,即Q<K,所以平衡会正向移动。
A.由分析可知,平衡正向移动,所以氢气会消耗,体积分数会减小,故A正确;
B.根据质量守恒定律可知,反应前后气体的质量保持不变,又该反应在恒容密闭容器中进行,由密度=质量/体积可知,密度保持不变,故B错误;
C.由分析可知,平衡正向移动,碘单质会转化成碘化氢,碘单质为紫黑色,所以混合气体的颜色会变浅,故C错误;
D.根据反应方程式可知,前后气体系数之和相等,即反应前后气体的物质的量保持不变,所以压强保持不变,故D错误;
综上所述,答案为A。

练习册系列答案
相关题目
【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大