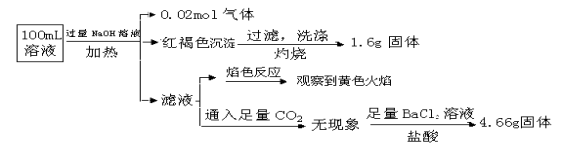
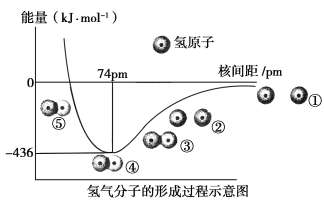
题目内容
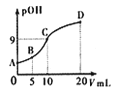
【题目】氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定10mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中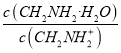 =2.5×10-5
=2.5×10-5
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
【答案】C
【解析】A.甲胺是弱电解质,在水中的电离方程式为CH3NH2·H2O![]() CH3NH3++OH-,故A错误;
CH3NH3++OH-,故A错误;
B.C点为完成中和点,只存在盐类水解促进水的电离,A点只有甲胺的电离抑制水的电离,则A、B、C三点溶液中,水电离出来的c(H+)为C>B>A,故B错误;C.C点只存在盐类水解,此时溶液中c(H+)=1.0×10-5mol/L,则![]() ×c(H+)=Kw/Kb,
×c(H+)=Kw/Kb,![]() =Kw/[Kb×c(H+)]=(1×10-14)/[(4.0×10-5)×1.0×10-5]=2.5×10-5,故C正确;D.B点溶液中存在的CH3NH2·H2O电离和CH3NH3+的水解,此时溶液显碱性,即,故D错误;答案为C。
=Kw/[Kb×c(H+)]=(1×10-14)/[(4.0×10-5)×1.0×10-5]=2.5×10-5,故C正确;D.B点溶液中存在的CH3NH2·H2O电离和CH3NH3+的水解,此时溶液显碱性,即,故D错误;答案为C。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
【题目】为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
物质 | 试剂 | 分离方法 | |
① | 乙烷(乙烯) | H2 | 催化剂加热 |
② | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
③ | 乙醇(水) | 生石灰 | 蒸馏 |
④ | 苯(苯酚) | 浓溴水 | 分液 |
A. ①② B. ①③ C. ③④ D. 只有③