题目内容
【题目】利用如图所示装置可以模拟铁的电化学防护。下列说法不正确的是 ( )
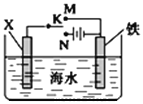
A.若X为碳棒,开关K置于N处,为外加电源的阴极保护法,可减缓铁的腐蚀
B.若X为碳棒,开关K置于N处,X极发生氧化反应
C.若X为锌棒,开关K置于M处,为牺牲阳极的阴极保护法,可减缓铁的腐蚀
D.若X为锌棒,开关K置于M处,铁极发生氧化反应
【答案】D
【解析】
A. 若X为碳棒,开关K置于N处,为外加电源的阴极保护法,铁棒作阴极,可阻止铁失电子,A正确;
B. 若X为碳棒,开关K置于N处,X极为阳极,失电子发生氧化反应,B正确;
C. 若X为锌棒,开关K置于M处,为牺牲阳极的阴极保护法,由于锌的金属活动性大于铁,所以铁棒作正极,可阻止铁失电子,C正确;
D. 若X为锌棒,开关K置于M处,铁电极为正极,得电子发生还原反应,D错误。
故选D。

【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
A.AB.BC.CD.D
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。