题目内容
【题目】某学习小组设计如图装置,验证黄铜矿(主要成分CuFeS2)在空气中的氧化产物并测定CuFeS2的纯度(杂质不参与反应)。
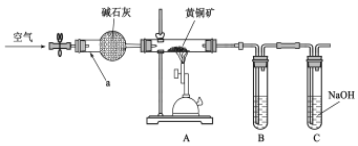
回答下列问题。
(1)仪器a的名称_________,碱石灰的作用______________________________________。
(2)为检验灼烧黄铜矿产生的气体,B中可选__________________
a.HNO3溶液 b.品红溶液 c.BaCl2溶液 d.溴水 e.KMnO4溶液
(3)C中NaOH的作用____________________________________________________
(4)样品经煅烧后的固体中铜元素以泡铜(Cu、Cu2O)形式存在,其中Cu2O能与稀H2SO4反应生成Cu和CuSO4。
①请设计实验验证泡铜中含有Cu2O____________________________________________。
②用泡铜与CO反应来制取粗铜装置如下图,实验时依次进行的操作:
组装仪器→检查装置气密性→加装药品→____________→____________→…→尾气处理;CO还原Cu2O的化学方程式_______________________________________________
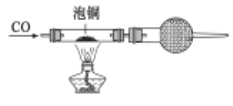
(5)为测定CuFeS2的纯度,称取a g黄铜矿样品充分灼烧,从灼烧产物中分离出泡铜,完全溶于稀硝酸,并配成200 mL的溶液,取20.00 mL该溶液用c mol· L-1的标准液EDTA(用H2Y2-表示)滴定至终点(标准液不与杂质反应),消耗EDTA V mL,则CuFeS2的纯度为____________。(滴定时的反应为:Cu2++H2Y2-===CuY2-+2H+)
【答案】(球形)干燥管 吸收通入空气中的二氧化碳和水蒸气 bde 吸收多余的SO2 取少量泡铜于试管中,加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O 通入气体 点燃酒精灯 CO+Cu2O![]() 2Cu+CO2
2Cu+CO2 ![]()
【解析】
空气通过球形干燥管除掉二氧化碳和水蒸气,酒精喷灯高温灼烧装置A,CuFeS2被氧气氧化,B装置用来检验灼烧黄铜矿产生的气体二氧化硫,C装置吸收多余的SO2,防止污染环境。
(1)仪器a的名称球形干燥管,碱石灰的作用吸收通入空气中的二氧化碳和水蒸气;
答案:球形干燥管 吸收通入空气中的二氧化碳和水蒸气
(2)灼烧黄铜矿产生的气体是二氧化硫;
a.HNO3溶液可以氧化二氧化硫,但是可能没有明显的现象,且会产生不能被氢氧化钠溶液吸收的污染性气体NO,故不选a;
b.二氧化硫气体可以漂白品红溶液,故选b;
c.二氧化硫气体不与BaCl2溶液反应,故不选C;
d.二氧化硫与溴可发生氧化还原反应,使溴水褪色,故选d
e.二氧化硫与KMnO4溶液可发生氧化还原反应,使酸性高锰酸钾褪色,故选e;
答案:bde
(3)C中NaOH是用来吸收多余的二氧化硫气体,防止污染环境;
答案:吸收多余的SO2
(4)①因为铜排在氢后面,不与稀硫酸反应,而Cu2O能与稀H2SO4反应生成Cu和CuSO4,所以可以用稀硫酸验证;
答案:取少量泡铜于试管中,加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O
②实验开始之前先除掉装置中的空气,再加热,否则CO与空气混合加热可能会引起爆炸;因此步骤:组装仪器→检查装置气密性→加装药品→通入气体→点燃酒精灯→…→尾气处理;CO还原Cu2O的化学方程式CO+Cu2O![]() 2Cu+CO2;
2Cu+CO2;
答案:通入气体 点燃酒精灯CO+Cu2O![]() 2Cu+CO2
2Cu+CO2
(5)根据关系式进行计算:
CuFeS2 ~ Cu2+ ~ H2Y2-
1mol 1mol 1mol
n(CuFeS2) cV×10-3×![]()
得:n(CuFeS2)=cV×10-2mol
纯度为:![]() =
=![]()
答案:![]()

 阅读快车系列答案
阅读快车系列答案【题目】下表中实验操作、现象与结论对应关系正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 用广泛pH试纸测定1mol/L NaHSO3 溶液的酸碱性 | 测得pH=3.2 | NaHSO3 溶液呈酸性,证明HSO3-的电离大于水解 |
C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
D | 在0.1mol/LNa2S溶液中滴加少量等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液 | 先产生白色ZnS沉淀,后产生黑色CuS沉淀 | Ksp(ZnS)>Ksp(CuS) |
A.AB.BC.CD.D