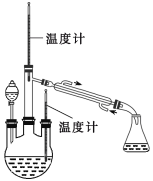
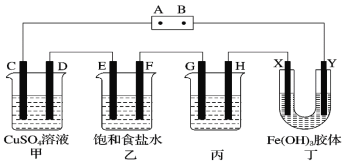
题目内容
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
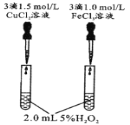
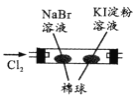
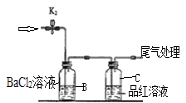
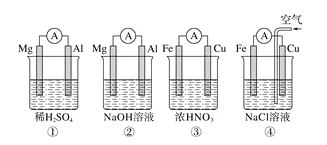
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
A.AB.BC.CD.D
【答案】A
【解析】
A.氯离子浓度相同时,Fe3+浓度小,但产生的气泡速度快,催化活性:Fe3+>Cu2+,故选项A正确;
B.氯气过量条件下,也能与KI溶液反应,无法判断Br2能否与KI溶液反应,故选项B错误;
C.硫酸亚铁铵分解的产物中含有SO2,硫元素化合价降低被还原,由氧化还原反应规律可知,铵根离子中的氮元素化合价升高被氧化,发生还原反应生成氮气,则分解产物中应该含有氮气,故选项C错误;
D.盐酸为挥发性酸,挥发的HCl也能与Na2SiO3溶液反应,干扰二氧化碳与硅酸钠溶液的反应,不能证明非金属性:C>Si,故选项D错误;
故选A。

练习册系列答案
相关题目
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%