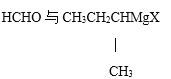题目内容
【题目】若用AG表示溶液的酸度,其表达式为![]() 。室温下,实验室里用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1MOH溶液,滴定曲线如图所示。下列说法正确的是
。室温下,实验室里用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1MOH溶液,滴定曲线如图所示。下列说法正确的是
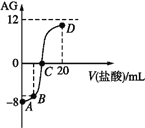
A. MOH为强碱
B. C点时加入盐酸的体积等于10mL
C. 若B点加入的盐酸体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-)
D. 滴定过程中从A点到D点溶液中水的电离程度:A<B<C<D
【答案】C
【解析】A,没有滴入盐酸时,0.1mol/LMOH溶液的AG=-8,即0.1mol/LMOH溶液中c(OH-)=1![]() 10-3mol/L
10-3mol/L![]() 0.1mol/L,MOH为弱碱,A项错误;B,若加入10mL盐酸,MOH与HCl恰好完全反应得到MCl溶液,MCl溶液呈酸性,MCl溶液的AG
0.1mol/L,MOH为弱碱,A项错误;B,若加入10mL盐酸,MOH与HCl恰好完全反应得到MCl溶液,MCl溶液呈酸性,MCl溶液的AG![]() 0,C点溶液的AG=0,溶液中c(H+)=c(OH-),溶液呈中性,C点时加入盐酸的体积小于10mL,B项错误;C,若B点加入盐酸的体积为5mL,盐酸与MOH充分反应后得到等物质的量浓度的MCl和MOH的混合溶液,溶液中的电荷守恒为c(M+)+c(H+)=c(Cl-)+c(OH-),物料守恒为c(M+)+c(MOH)=2c(Cl-),两式整理得c(M+)+2c(H+)=c(MOH)+2c(OH-),C项正确;D,开始MOH电离出OH-抑制水的电离,随着盐酸的滴入,溶液中OH-浓度减小,OH-对水的抑制程度减小,同时生成MCl,MCl水解促进水的电离,随着盐酸的滴入,水的电离程度逐渐增大,当滴入10mL盐酸时MOH与HCl恰好完全反应得到MCl溶液,此时水的电离程度最大,继续滴入盐酸,过量盐酸电离出H+抑制水的电离,水的电离程度又逐渐减小,D点加入20mL盐酸,盐酸与MOH充分反应后得到物质的量浓度均为
0,C点溶液的AG=0,溶液中c(H+)=c(OH-),溶液呈中性,C点时加入盐酸的体积小于10mL,B项错误;C,若B点加入盐酸的体积为5mL,盐酸与MOH充分反应后得到等物质的量浓度的MCl和MOH的混合溶液,溶液中的电荷守恒为c(M+)+c(H+)=c(Cl-)+c(OH-),物料守恒为c(M+)+c(MOH)=2c(Cl-),两式整理得c(M+)+2c(H+)=c(MOH)+2c(OH-),C项正确;D,开始MOH电离出OH-抑制水的电离,随着盐酸的滴入,溶液中OH-浓度减小,OH-对水的抑制程度减小,同时生成MCl,MCl水解促进水的电离,随着盐酸的滴入,水的电离程度逐渐增大,当滴入10mL盐酸时MOH与HCl恰好完全反应得到MCl溶液,此时水的电离程度最大,继续滴入盐酸,过量盐酸电离出H+抑制水的电离,水的电离程度又逐渐减小,D点加入20mL盐酸,盐酸与MOH充分反应后得到物质的量浓度均为![]() mol/LMCl和HCl的混合溶液,HCl完全电离产生的c(H+)=
mol/LMCl和HCl的混合溶液,HCl完全电离产生的c(H+)=![]() mol/L
mol/L![]() 1
1![]() 10-3mol/L[A点MOH溶液中c(OH-)],D点溶液中水的电离程度小于A点,从A点到D点溶液中水的电离程度:D
10-3mol/L[A点MOH溶液中c(OH-)],D点溶液中水的电离程度小于A点,从A点到D点溶液中水的电离程度:D![]() A
A![]() B
B![]() C,D项错误;答案选C。
C,D项错误;答案选C。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
A.用CCl4提取溴水中的Br2[来 | B.从KI和I2的固体混合物中回收I2 | C.吸收NH3(极易溶于水),并防止倒吸 | D.工业酒精制备无水酒精 |
|
|
|
|
A. A B. B C. C D. D