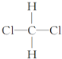题目内容
【题目】(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为__________________________。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如下图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。

(II)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

请回答下列问题:
(3)A的仪器名称为_____________。
(4)如下图所示,泡沫塑料板上面有两个小孔,两个小孔不能开得过大,其原因是____________;反应需要测量温度,每次测量温度后都必须采取的操作是____________________。
(5)某学生实验记录数据如下:
实验序号 | 起始温度t1 ℃ | 终止温度t2 ℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
已知盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
(6)假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
【答案】 N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1 x=![]() (d+6a+5c-12b) 环形玻璃搅拌棒 减少热量损失 用水将温度计上的液体冲掉,并擦干温度计 -51.8 kJ/mol 不相等 相等
(d+6a+5c-12b) 环形玻璃搅拌棒 减少热量损失 用水将温度计上的液体冲掉,并擦干温度计 -51.8 kJ/mol 不相等 相等
【解析】(I)(1)反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态肼放出的热量,计算1mol液态肼放出的热量,进而写出热化学方程式;
(2)白磷燃烧的方程式为P4+5O2=P4O10,根据化学键的断裂和形成的数目进行计算;
(II)(3)根据测定中和热使用的仪器分析解答;
(4)根据测定中和热过程中必须尽量减少热量的散失分析;
(5)先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=cm△T计算出反应放出的热量,最后计算出中和热;
(6)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答。
(I)(1)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652kJ的热量,则1mol液态肼放出的热量为![]() =641.63kJ,所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol,故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol;
=641.63kJ,所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol,故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol;
(2)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,所以(6mol×a kJ/mol+5 mol×c kJ/mol)-12mol×bkJ/mol+4mol×xkJ/mol=-dkJ/mol,x=![]() kJ/mol,故答案为:
kJ/mol,故答案为:![]() ;
;
(II)(3)根据图示,仪器A是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(4)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,若两个小孔开得过大,会导致散失较多的热量,影响测定结果;
中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,温度差偏低,但使测得的中和热偏高,所以每次测量后用水将温度计上的液体冲掉,并擦干温度计;故答案为:减少热量散失;用水将温度计上的液体冲掉,并擦干温度计;
(5)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为:3.15℃;第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应前后温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应前后温度差为:3.05℃;40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液的质量和为m=80mL×1g/cm3=80g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g℃)×80g×![]() =1.036kJ,即生成0.02mol的水放出热量为:1.036kJ,所以生成1mol的水放出热量为:1.036kJ×
=1.036kJ,即生成0.02mol的水放出热量为:1.036kJ,所以生成1mol的水放出热量为:1.036kJ×![]() =-51.8kJ/mol,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
=-51.8kJ/mol,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
(6)反应放出的热量和所用酸以及碱的量的多少有关,若用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增加,所放出的热量增多,但是中和热是稀的强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行上述实验,测得中和热数值相等,故答案为:不相等;相等。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10﹣18 | 1.3×10﹣36 | 2.5×10﹣13 |
下列有关说法中正确的是( )
A.25℃时,CuS的溶解度大于MnS的溶解度
B.25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10﹣36 molL﹣1
C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+ , 可以选用FeS作沉淀剂