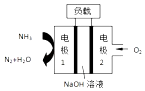
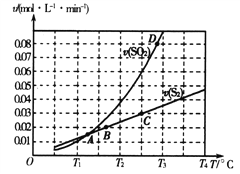
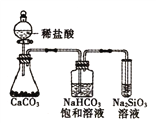
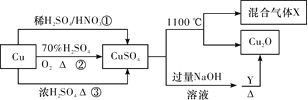
题目内容
【题目】根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A.H3PO4的酸性比HNO3弱
B.砹(At)的氢化物不稳定
C.硒(Se)化氢比硫化氢稳定
D.氢氧化钡比氢氧化钙的碱性强
【答案】C
【解析】解:A.非金属性N>P,则H3PO4的酸性比HNO3弱,故A正确;
B.At在第ⅤⅡA族中非金属性最弱,则砹(At)的氢化物不稳定,故B正确;
C.非金属性S>Se,硒(Se)化氢不如硫化氢稳定,故C错误;
D.金属性Ba>Ca,氢氧化钡比氢氧化钙的碱性强,故D正确;
故选C.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案【题目】(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为__________________________。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如下图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。

(II)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

请回答下列问题:
(3)A的仪器名称为_____________。
(4)如下图所示,泡沫塑料板上面有两个小孔,两个小孔不能开得过大,其原因是____________;反应需要测量温度,每次测量温度后都必须采取的操作是____________________。
(5)某学生实验记录数据如下:
实验序号 | 起始温度t1 ℃ | 终止温度t2 ℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
已知盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
(6)假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。