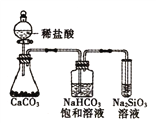
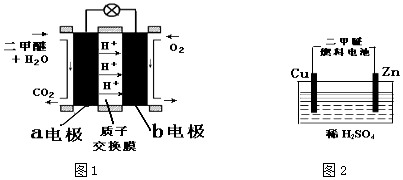
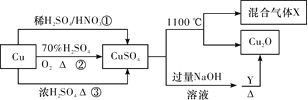
题目内容
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,m在常温下为无色无味的液体,n是元素z的单质,通常为黄绿色气体。r溶液为常见的一元强酸,p分子的空间构型为正四面体,s通常是难溶于水的混合物。上述物质的转化关系如图所示。
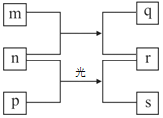
(1)Y形成的简单阴离子结构示意图为_________。
(2)n的电子式为_________。
(3)请列举q的一种用途________。
(4)W、X、Y原子半径的由大到小的顺序为_______(用元素符号表示)。
(5)写出n、p第一步反应的化学方程式________。
【答案】 ![]()
![]() 漂白剂(或杀菌消毒) C>O>H CH4 + Cl2
漂白剂(或杀菌消毒) C>O>H CH4 + Cl2 ![]() CH3Cl + HCl
CH3Cl + HCl
【解析】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,则n为Cl2,Z为Cl,氯气与p在光照条件下生成r与s,r为一元酸,则r为HCl,p分子的空间构型为正四面体,s通常是难溶于水的混合物,p为CH4,氯气与m反应生成HCl与q,q的水溶液具有漂白性,则m为H2O,q为HClO,结合原子序数可以知道W为H元素,X为C元素,Y为O元素,结合元素周期律解答。
详解:由上述分析可以知道,W为H,X为C,Y为O,Z为Cl,
(1)O2-有2个电子层,最外层电子数为8,结构示意图为![]() ,
,
故答案为:![]() ;
;
(2)Cl2分子中两个氯原子共用一对电子,每个Cl都达到8个电子稳定结构,电子式为![]() ,
,
故答案为:![]() ;
;
(3)次氯酸具有强氧化性,可用作漂白剂(或杀菌消毒)。
故答案为:漂白剂(或杀菌消毒);
(4)同一周期从左到右原子半径逐渐减小,电子层数越多原子半径越大,所以H、C、O原子半径的由大到小的顺序为C>O>H。
(5)甲烷和氯气在光照条件下发生分步取代反应,第一步反应的化学方程式CH4 + Cl2 ![]() CH3Cl + HCl,
CH3Cl + HCl,
故答案为:CH4 + Cl2 ![]() CH3Cl + HCl。
CH3Cl + HCl。

【题目】(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为__________________________。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如下图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。

(II)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

请回答下列问题:
(3)A的仪器名称为_____________。
(4)如下图所示,泡沫塑料板上面有两个小孔,两个小孔不能开得过大,其原因是____________;反应需要测量温度,每次测量温度后都必须采取的操作是____________________。
(5)某学生实验记录数据如下:
实验序号 | 起始温度t1 ℃ | 终止温度t2 ℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
已知盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
(6)假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。