��Ŀ����
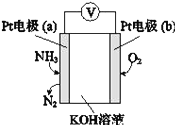
����Ŀ����ͨп�̸ɵ�صĽṹ��ͼ��ʾ���ش��������⡣
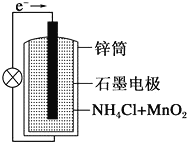
��1�� �ٵ���е������ҺΪ________��
��������ӦʽΪ_______________��
�۷ŵ�ʱ��NH4+��______�������������������������ƶ���
��2���ϵ���е�пƤ������ʵ��������������пƤ�ʹ�п���ֱ���ͬŨ�ȵ�ϡ���ᷴӦ�������������ʽϴ����____��ԭ����____�����ù����Ĵ�п����һ������ϡ���ᷴӦ��Ϊ�˼ӿ췴Ӧ�����ֲ�Ӱ������������������д�ʩ���е���_____������ţ���
A���� B��������������ͭ
C��������������ͭ��Һ D����ˮ
E��������������������Һ
���𰸡���1����NH4Cl�����Ȼ�泥���Һ ��2MnO2��2NH4+��2e��=Mn2O3��H2O��2NH3������
��2����пƤ����пƤ��ϡ�����пɹ���ԭ��أ��ӿ츺��ʧ�������ʣ���Ӧ�����������ʽϴ�AC
��������
��1���õ�صĹ���ԭ��������ʧȥ���ӱ������������ϸ������ӣ��������������ƶ�����2����Ӱ�컯ѧ��Ӧ���ʵĽǶȿ��ǣ�����ԭ����ܼӿ츺��ʧ���ӡ�

��ϰ��ϵ�д�
�����Ŀ