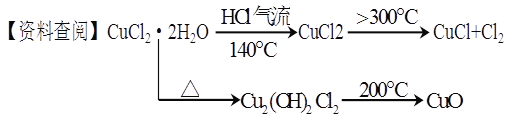题目内容
【题目】常温下,向100mL 0.1mol/L的H2A溶液中滴加0.1mol/LNaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是
A. H2A在水中的电离方程式是:H2A=H++HA-, HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. Y点溶液中存在以下关系: c(H+)+c(Na+)=c(OH-)+3c(HA-)
D. X点溶液中含A元素相关微粒:c(H2A)+c(HA-)+c(A2-)=0.1mol/L
【答案】C
【解析】
本题考查酸碱混合溶液的定性判断,明确图像中酸碱混合时溶液中的溶质时解答本题的关键,抓住图像进行分析即可,难度中等。
A.从图像分析溶液中含有H2A分子,说明H2A为弱酸,则电离方程式为:H2A![]() H++HA-, HA-
H++HA-, HA-![]() H++A2-,故错误;B.等体积等浓度的氢氧化钠溶液与H2A溶液混合后,溶液主要为NaHA,电离为主,溶液显酸性,溶液中的氢离子会抑制水的电离,溶液中水的电离程度比纯水中小,故错误;C. 电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2--),从图像分析,c(HA-)= c(A2--),从而得c(H+)+c(Na+)=c(OH-)+3c(HA-),故正确;D.100mL0.1mol/L的H2A溶液中滴加0.1mol/LNaOH溶液,到X点时溶液的体积肯定比原来的大,所以根据物料守恒分析,有c(H2A)+c(HA-)+c(A2-)<0.1mol/L,故错误。故选C。
H++A2-,故错误;B.等体积等浓度的氢氧化钠溶液与H2A溶液混合后,溶液主要为NaHA,电离为主,溶液显酸性,溶液中的氢离子会抑制水的电离,溶液中水的电离程度比纯水中小,故错误;C. 电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2--),从图像分析,c(HA-)= c(A2--),从而得c(H+)+c(Na+)=c(OH-)+3c(HA-),故正确;D.100mL0.1mol/L的H2A溶液中滴加0.1mol/LNaOH溶液,到X点时溶液的体积肯定比原来的大,所以根据物料守恒分析,有c(H2A)+c(HA-)+c(A2-)<0.1mol/L,故错误。故选C。

 阅读快车系列答案
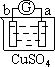
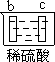
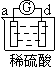
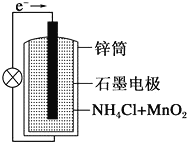
阅读快车系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c