题目内容
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
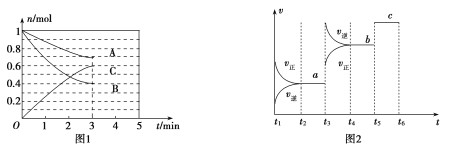
(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为![]() ________。
________。
(2)从开始到平衡C的平均反应速率v(C)=________________。该反应的![]() ________0。(填“
________0。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
(3)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在![]() 时刻改变的外界条件是________。
时刻改变的外界条件是________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 之间的关系为_______(用“
之间的关系为_______(用“![]() ”、“
”、“![]() ”或“
”或“![]() ”连接)。
”连接)。
【答案】![]()
![]()
![]() < 升高温度 a
< 升高温度 a ![]()
【解析】
根据图一可知到达平衡时A、B两种物质分别反应了0.3mol、0.6mol,C生成了0.6mol,故该反应的化学方程式为![]() ,从而有:
,从而有:
![]()
起始n/(![]() ) 1 1 0
) 1 1 0
变化n/(![]() ) 0.3 0.6 0.6
) 0.3 0.6 0.6
平衡n/(![]() ) 0.7 0.4 0.6
) 0.7 0.4 0.6
(1)由分析可知该反应的化学方程式为:![]() ;由化学方程式可知,平衡常数的表达式为
;由化学方程式可知,平衡常数的表达式为![]() ;
;
(2)从开始到平衡C的浓度变化为:0.12mol·L-1,时间为3min,故![]() ;由题干达平衡后,降低温度,A的体积分数减小,说明平衡向正反应方向移动,反应放热,故
;由题干达平衡后,降低温度,A的体积分数减小,说明平衡向正反应方向移动,反应放热,故![]() ;
;
(3)①结合图一所得化学方程式及图二,![]() 时刻改变条件后正逆反应速率均增大,故改变的条件可能有升高温度、添加催化剂、增大压强,但
时刻改变条件后正逆反应速率均增大,故改变的条件可能有升高温度、添加催化剂、增大压强,但![]() 平衡向逆反应方向移动,故只能是升高温度;
平衡向逆反应方向移动,故只能是升高温度;
②![]() 为平衡状态,
为平衡状态,![]() 平衡向逆反应方向移动,C的体积分数减小,
平衡向逆反应方向移动,C的体积分数减小,![]() 时刻突变(加入催化剂导致)后,平衡未移动,C的体积分数不变,故C的体积分数最大的是a。
时刻突变(加入催化剂导致)后,平衡未移动,C的体积分数不变,故C的体积分数最大的是a。
③![]() 为平衡状态,达平衡后,降低温度,
为平衡状态,达平衡后,降低温度,![]() 平衡向逆反应方向移动,
平衡向逆反应方向移动,![]() 时刻突变(加入催化剂导致)后,平衡未移动,故
时刻突变(加入催化剂导致)后,平衡未移动,故![]() 。
。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案