题目内容
【题目】黄铜矿![]() 是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
![]() 冶炼铜的反应为
冶炼铜的反应为 若
若![]() 中Fe的化合价为
中Fe的化合价为![]() ,反应中被还原的元素是______
,反应中被还原的元素是______![]() 填元素符号
填元素符号![]() .
.
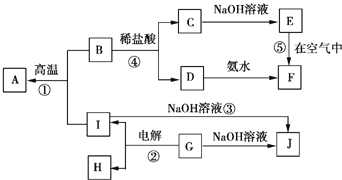
![]() 冶炼铜的主要流程如图:
冶炼铜的主要流程如图:

![]() 气体A中的大气污染物可选用下列试剂中的______吸收.
气体A中的大气污染物可选用下列试剂中的______吸收.
![]() 浓
浓![]()
![]() 稀
稀![]()
![]() 溶液
溶液
![]() 用稀
用稀![]() 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为
浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为![]() 的结论.请指出该结论是否合理并说明理由______.
的结论.请指出该结论是否合理并说明理由______.
![]() 冶炼出的铜可以发生下列反应
冶炼出的铜可以发生下列反应![]() 图
图![]()
![]() 写出Cu溶于稀
写出Cu溶于稀![]() 和
和![]() 混合液的离子方程式:______.
混合液的离子方程式:______.
![]() 写出
写出![]() 将Z氧化为
将Z氧化为![]() 的化学方程式:______.
的化学方程式:______.
![]() 对于
对于![]()
![]() 溶液,正确的是______.
溶液,正确的是______.
A、常温下,![]()
B、![]()
C、![]()
【答案】Cu、O c 该结论不正确,稀![]() 有强氧化性,若该铁的价态为
有强氧化性,若该铁的价态为![]() 价,则被氧化为
价,则被氧化为![]() 价同样可使KSCN溶液变血红色
价同样可使KSCN溶液变血红色 ![]()
![]() C
C
【解析】
 中,Fe元素的化合价升高,Cu、O元素的化合价降低;
中,Fe元素的化合价升高,Cu、O元素的化合价降低;
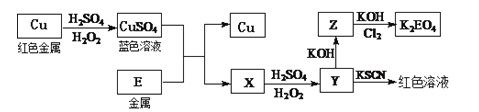
![]() 冶炼铜的主要流程:黄铜矿与石英砂、空气混合焙烧得到冰铜
冶炼铜的主要流程:黄铜矿与石英砂、空气混合焙烧得到冰铜![]() ,加入石英砂通入空气焙烧,生成
,加入石英砂通入空气焙烧,生成![]() 、Cu,生成气体A为二氧化硫,熔渣为
、Cu,生成气体A为二氧化硫,熔渣为![]() 等,其中熔渣经过硫酸溶解过滤除去不溶于酸的
等,其中熔渣经过硫酸溶解过滤除去不溶于酸的![]() 和含有铁元素的相关离子的酸性溶液,利用过量氢氧化钠溶液进行分离得到氢氧化铁沉淀,过滤洗涤灼烧得到氧化铁,泡铜与Al通过铝热反应得到粗铜,再利用电解得到精铜;
和含有铁元素的相关离子的酸性溶液,利用过量氢氧化钠溶液进行分离得到氢氧化铁沉淀,过滤洗涤灼烧得到氧化铁,泡铜与Al通过铝热反应得到粗铜,再利用电解得到精铜;
![]() 铜溶于稀
铜溶于稀![]() 和
和![]() 混合液生成硫酸铜,与E发生置换反应生成铜单质和另一金属盐X,X与稀
混合液生成硫酸铜,与E发生置换反应生成铜单质和另一金属盐X,X与稀![]() 和
和![]() 混合液生成的Y可KSCN溶液变血红色,则为铁离子,故E为Fe,X为
混合液生成的Y可KSCN溶液变血红色,则为铁离子,故E为Fe,X为![]() ,Y为
,Y为![]() ,Z为
,Z为![]() ,据此分析作答。
,据此分析作答。
 中,Fe元素的化合价升高,Cu、O元素的化合价降低,则Cu、O元素被还原;
中,Fe元素的化合价升高,Cu、O元素的化合价降低,则Cu、O元素被还原;
![]() 由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,a、浓
由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,a、浓![]() 不能吸收二氧化硫,故错误;
不能吸收二氧化硫,故错误;
b、稀![]() 可以吸收二氧化硫,但生成NO污染大气,故错误;
可以吸收二氧化硫,但生成NO污染大气,故错误;
c、NaOH溶液与二氧化硫反应生成亚硫酸钠,故正确;
故答案为:c;
![]() 用稀
用稀![]() 浸泡熔渣B,若含有亚铁离子,被氧化为铁离子,也会使KSCN溶液变血红色,故该结论不正确;
浸泡熔渣B,若含有亚铁离子,被氧化为铁离子,也会使KSCN溶液变血红色,故该结论不正确;
![]() 由流程可知,Cu溶于稀
由流程可知,Cu溶于稀![]() 和
和![]() 混合液生成硫酸铜,发生的离子方程式为:
混合液生成硫酸铜,发生的离子方程式为:![]() ;
;
![]() 由分析可知Z为
由分析可知Z为![]() ,E为Fe,
,E为Fe,![]() 将Z氧化为
将Z氧化为![]() ,铁元素化合价升高,则氯元素化合价降低为
,铁元素化合价升高,则氯元素化合价降低为![]() 价,发生的反应为:
价,发生的反应为:![]() ;
;
![]() 对于
对于![]()
![]() 溶液,
溶液,
A、常温下,铜离子发生水解,![]() ,
,![]() ,错误;
,错误;
B、铜离子发生水解,![]() ,错误;
,错误;
C、根据电荷守恒,![]() ,正确;
,正确;
故答案为:C;

 阅读快车系列答案
阅读快车系列答案【题目】某小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4gNa2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧列反应,产生能使带火星木条复燃的气体 |
取5mL溶液a于试管中,滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2与水反应的化学方程式___。
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应。
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂___(填化学式),有气体产生。
Ⅱ.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量:取15.00mL溶液a,用稀H2SO4酸化,逐滴加入0.003molL-1KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00mLKMnO4溶液。
请配平:___MnO4-+___H2O2+___=___Mn2++___O2↑+___H2O
②溶液a中c(H2O2)=___molL-1。
③溶液褪色速率开始较慢后变快的原因可能是___。
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅲ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1molL-1NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色。
Ⅳ.向0.1molL-1NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化。
①从实验Ⅲ和Ⅳ中,可得出的结论是___。
②同学们进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案是:取少量溶液a于试管中,___。