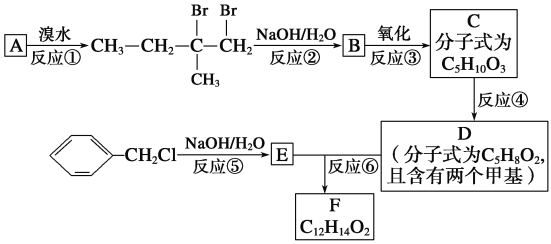
题目内容
【题目】某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图甲)从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化结果如图,下列叙述错误的是( )
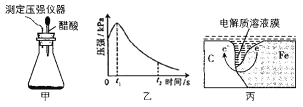
A.图丙中,发生腐蚀时电子转移方向如箭头所示
B.图乙中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀
C.碳粉表面的电极反应式只有:O2+4e-+2H2O=4OH-
D.若将丙图中的C 换成Zn,铁的腐蚀速率会大大降低,这是是利用了牺牲阳极的阴极保护法
【答案】C
【解析】
混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞,从胶头滴管中滴入几滴醋酸溶液,根据图乙的压强变化可知,开始时锥形瓶中压强增大,说明铁粉发生了析氢腐蚀,后随着醋酸的消耗,溶液酸性减弱,发生了吸氧腐蚀,则锥形瓶中压强减小,据此分析。
A.在形成的原电池中,铁粉作负极失去电子,碳粉作正极,氢离子或氧气在正极得电子,故电子的转移方向是由负极移向正极,A正确;
B.从胶头滴管中滴入几滴醋酸溶液,开始时锥形瓶中压强增大,说明铁粉发生了析氢腐蚀,后随着醋酸的消耗,溶液酸性减弱,说明后来发生了吸氧腐蚀,使锥形瓶中压强减小,B正确;
C.铁粉和碳粉形成原电池,碳粉作正极,开始时发生析氢腐蚀,正极反应为2H++2e-=H2↑,后来发生吸氧腐蚀,正极反应为:2H2O+O2+4e-=4OH-,C错误;
D.若将丙图中的C 换成Zn,根据金属活动性Zn>Fe,Zn作原电池的负极,失去电子,Fe作原电池的正极,因此使铁的腐蚀速率会大大降低,这是是利用了牺牲阳极的阴极保护法,D正确;
故合理选项是C。

【题目】某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
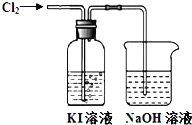
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与NaOH溶液反应的化学方程式是___。
(2)KI溶液变为黄色说明氯气具有的___性,该反应的离子方程式是___。
(3)已知I2+I-![]() I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
①实验b的目的是___。
②根据实验a中,水层中含有的粒子有___。
操作 | 实验现象 | |
a | 取2~3mL黄色溶液,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层显浅黄色 |
b | 取2~3mL饱和碘水,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层几近无色 |
③实验a中水溶液颜色变浅的原因是___。
④为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为___。
(4)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化,已知1molCl2可氧化0.2molI2,该反应的化学方程式是___。
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为___。
(6)溶液最终变为浅绿色的原因是___。