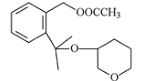
题目内容
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液B.降低温度
C.加少量冰醋酸D.加水
【答案】D
【解析】
醋酸是弱电解质,在溶液中存在电离平衡,要使溶液中![]() 值增大,应使平衡向右移动。
值增大,应使平衡向右移动。
A.加入少量烧碱溶液,反应H+生成CH3COO-,c(H+)减小,由于CH3COO-对CH3COOH的电离起到抑制作用,则![]() 值减小,故A错误;
值减小,故A错误;
B.醋酸的电离是吸热反应,降低温度,抑制醋酸电离,平衡向逆反应方向移动,则![]() 值减小,故B错误;
值减小,故B错误;
C.加入少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,则![]() 值减小,故C错误;
值减小,故C错误;
D.加水稀释促进醋酸电离,则氢离子的物质的量增大,醋酸分子的物质的量减小,所以![]() 值增大,故D正确;
值增大,故D正确;
故选D。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
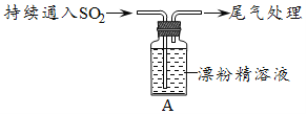
波波熊暑假作业江西人民出版社系列答案【题目】某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是___。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是___。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
A.用湿润的碘化钾淀粉试纸检验白雾,无变化;
B.用硝酸酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验A目的是___。
②由实验A、B不能判断白雾中含有HC1,理由是___。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是___。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是__。
②用离子方程式解释现象iii中黄绿色褪去的原因:__。
【题目】用O2将HCl转化为Cl2,反应方程式为:4HCl(g) + O2(g)![]() 2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A.0~2 min的反应速率小于4~6 min的反应速率
B.2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C.增大压强可以提高HCl转化率
D.平衡常数K(200℃)<K(400℃)
【题目】工业上可利用![]() 和
和![]() 制备多种物质。请回答下列问题:
制备多种物质。请回答下列问题:
(1)反应Ⅰ:![]() H1平衡常数为K1
H1平衡常数为K1
反应Ⅱ:![]() H2平衡常数为K2
H2平衡常数为K2
不同温度下,K1、K2的值如表所示:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高
H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高![]() 的转化率可采取的措施有________(写出任意两条)。
的转化率可采取的措施有________(写出任意两条)。
(2)一定条件下,在密闭容器中充入![]() 和
和![]() 进行如下反应:
进行如下反应:![]()
![]() 。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时
。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时![]() 的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
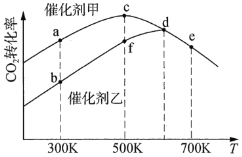
①该可逆反应的反应热H________0(填“>”或“<”)。
②催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能________(填“大”或“小”)。
③![]() 下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
④图中达到平衡的点是________。
(3)工业上常用高浓度的![]() 溶液吸收
溶液吸收![]() ,得到溶液X,再利用电解法使
,得到溶液X,再利用电解法使![]() 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:
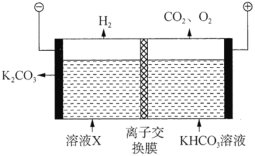
①在阳极区发生的反应有:________和![]() 。
。
②简述![]() 在阴极区再生的原理:________。
在阴极区再生的原理:________。