题目内容
20.聚碳酸酯无色透明,具有优异的抗冲击性,能用于制造宇航员的面罩、智能手机机身外壳等,属于可降解聚合物.G是合成聚碳酸酯的单体之一,其合成路线如下:
已知下列信息:a.
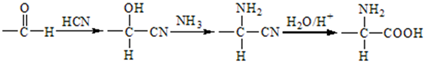
b.
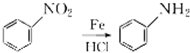
(1)A的含氧官能团名称是羟基,羧酸a的结构简式是CH3COOH.
(2)B→C的化学方程式是
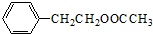 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$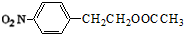 +H2O.
+H2O.(3)化合物D苯环上的一氯代物有2种,D的结构简式是
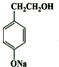 .
.(4)E→F中反应①和②的反应类型分别是加成反应、取代反应.
(5)F的结构简式是
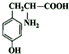 .
.(6)E的同分异构体中能发生银镜反应且与金属钠反应放出氢气的芳香化合物共有16种,其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:2:1的是
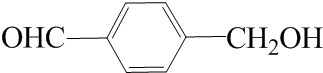 (写结构简式).
(写结构简式).
分析 根据流程图中转化关系,由第③步生成的物质结构中含有酯基,氨基,说明第③步发生硝基还原为氨基的反应,第②步是硝化反应,则C为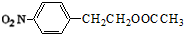 ,结合A的分子式可知,反应①反应为酯化反应,则B为
,结合A的分子式可知,反应①反应为酯化反应,则B为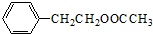 ,A为
,A为 .由G的结构简式,逆推可知F为
.由G的结构简式,逆推可知F为 ,结合E的分子式与反应信息可知,E为
,结合E的分子式与反应信息可知,E为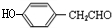 ,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为
,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为 ,据此解答.
,据此解答.
解答 解:根据流程图中转化关系,由第③步生成的物质结构中含有酯基,氨基,说明第③步发生硝基还原为氨基的反应,第②步是硝化反应,则C为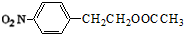 ,结合A的分子式可知,反应①反应为酯化反应,则B为
,结合A的分子式可知,反应①反应为酯化反应,则B为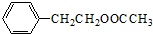 ,A为
,A为 .由G的结构简式,逆推可知F为
.由G的结构简式,逆推可知F为 ,结合E的分子式与反应信息可知,E为
,结合E的分子式与反应信息可知,E为 ,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为
,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为 ,
,
(1)A为 ,含有的官能团为羟基,B与羧酸发生酯化反应生成B,B为B为
,含有的官能团为羟基,B与羧酸发生酯化反应生成B,B为B为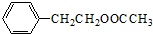 ,羧酸为CH3COOH,故答案为:羟基;CH3COOH;
,羧酸为CH3COOH,故答案为:羟基;CH3COOH;
(2)B为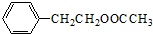 ,B通过硝化反应生成C,C为
,B通过硝化反应生成C,C为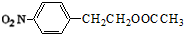 ,反应的化学方程式为
,反应的化学方程式为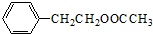 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$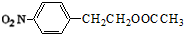 +H2O,
+H2O,
故答案为: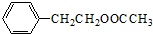 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$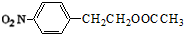 +H2O;
+H2O;
(3)E为 ,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为
,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为 ,D苯环上的一氯代物有2种,
,D苯环上的一氯代物有2种,
故答案为: ;
;
(4)由信息a可知,E→F的反应①是羰基与HCN的加成反应,反应②是-OH与-NH2的取代反应,故答案为:加成反应;取代反应;
(5)G的结构简式,逆推可知F为 ,故答案为:
,故答案为: ;
;
(6)E为 ,E的同分异构体中能发生银镜反应且与金属钠反应放出氢气的芳香化合物可以是2取代,分别是-OH和-CH2CHO临间对3种,-CH2OH
,E的同分异构体中能发生银镜反应且与金属钠反应放出氢气的芳香化合物可以是2取代,分别是-OH和-CH2CHO临间对3种,-CH2OH
和-CHO,邻间对3种,三取代时,取代基分别是-OH、-CH3、-CHO,用定一移二法判断其同分异构体有10种,所以E的同分异构体有16种,其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:2:1的是 ,
,
故答案为:16; .
.
点评 本题考查有机物的推断与合成,充分利用G的结构与反应③的产物结构进行推断,需要学生熟练掌握官能团的性质与转化,既注重基础知识巩固训练,又较好的考查学生分析推理能力与知识迁移应用,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案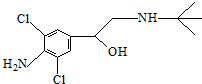
| A. | 该物质在一定条件下可发生消去反应和酯化反应 | |
| B. | 该物质分子中含有6个饱和碳原子 | |
| C. | 1 mol该物质与足量NaOH溶液反应,最多需NaOH 2 mol | |
| D. | 该物质的分子式为C12H18ON2Cl2 |
| A. | C3H6、C2H4 | B. | C2H6、C2H6O | C. | C2H4、C2H6O | D. | C3H4、C2H6O |
| A. | I2微溶于水,易溶于CCl4;HCl易溶于水 | |
| B. | 在水中的溶解度:C2H5OH>CH3CH2CH2CH2OH | |
| C. | 不同的烃之间相互溶解 | |
| D. | I2易溶于KI溶液中 |
| A. | 氢氧化钠溶液 | B. | 盐酸 | C. | 硫酸钠溶液 | D. | AgNO3溶液 |
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol |
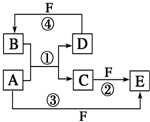 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).