��Ŀ����
����Ŀ���������״���;����㷺��Խ��Խ�����̼ҵĹ�ע����ҵ�ϼ״��ĺϳ�;�����ֶ���������ʵ������ģ��״��ϳɷ�Ӧ����2 L�ܱ������ڣ�400 ��ʱ������Ӧ��CO(g)+2H2(g)![]() CH3OH(g)����ϵ�м״������ʵ���n(CH3OH)��ʱ��ı仯�����
CH3OH(g)����ϵ�м״������ʵ���n(CH3OH)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 5 |
n(CH3OH) (mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
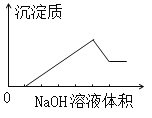
��1����ͼ�б�ʾCH3OH��Ũ�ȱ仯��������_________������ĸ����

��2����H2��ʾ��0~2s�ڸ÷�Ӧ��ƽ������v(H2) ��__________�����ŷ�Ӧ�Ľ��У��÷�Ӧ��������������ԭ���� _____________��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��������CO��CH3OH��Ũ����� b��v��(CO) �� v��(H2)
c��������������ܶȱ��ֲ��� d�������������ѹǿ����
��4���÷�Ӧ��һ�����ȷ�Ӧ��˵���÷�Ӧ���ƻ�1mol CO��2mol H2�Ļ�ѧ�����յ�����_________�γ�1mol CH3OH�ͷŵ����������������=����������
��5����֪��400 ��ʱ����ӦCO(g)+2H2(g)![]() CH3OH(g) ����1 mol CH3OH(g)���ų�������Ϊ116 kJ������������Ӧ�ﵽƽ��ʱ�ų�������Q ��_________kJ��
CH3OH(g) ����1 mol CH3OH(g)���ų�������Ϊ116 kJ������������Ӧ�ﵽƽ��ʱ�ų�������Q ��_________kJ��
���𰸡� b 0.006 mol /��L��s�� ��Ӧ���Ũ�ȼ�С d �� 1.508
����������1�� CH3OH�Dz���,�淴Ӧ�������ʵ�������,ƽ��ʱ���ʵ���Ϊ0.013 mol����2 L�ܱ������ڣ��״���Ũ��Ϊ0.013/2=0.0065mol/L, ����ͼ�������ֻ��b��������ȷ����b��
��2����2 L�ܱ������ڣ�0~2s�ڣ��״��仯��0.012 mol�����ݷ���ʽCO(g)+2H2(g)![]() CH3OH(g)��֪�������仯��0.024 mol��Ũ�ȱ仯��0.012 mol/L, v(H2) ��0.012/2=0.006 mol /��L��s�������ŷ�Ӧ�Ľ��У���Ӧ���Ũ�ȼ�С���÷�Ӧ����������������ȷ����0.006 mol /��L��s���� ��Ӧ���Ũ�ȼ�С��
CH3OH(g)��֪�������仯��0.024 mol��Ũ�ȱ仯��0.012 mol/L, v(H2) ��0.012/2=0.006 mol /��L��s�������ŷ�Ӧ�Ľ��У���Ӧ���Ũ�ȼ�С���÷�Ӧ����������������ȷ����0.006 mol /��L��s���� ��Ӧ���Ũ�ȼ�С��
��3��ƽ��ʱŨ�Ȳ��ٷ����仯��������֮���Ũ�Ȳ�һ����Ȼ�����ij�ֹ�ϵ��a����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮��������2v��(CO) �� v��(H2)����Ӧ�ﵽƽ��״̬��v��(CO) �� v��(H2) ����������ϵ���ȹ�ϵ��b����Ӧǰ�������������ʼ�ձ��ֲ��䣬���������Ҳ���䣬��˻��������ܶ�ʼ�ձ��ֲ��䣬�����ж���Ӧ�Ƿ�ﵽƽ��״̬��c����Ӧǰ�������������ͬ��ѹǿ����˵����Ӧ�ﵽƽ��״̬��d��ȷ����ȷѡ��d��
��4����Ӧ��H =��Ӧ��ϼ����յ�������-������ɼ��ų�������������Ϊ�÷�Ӧ��һ�����ȷ�Ӧ������H<0��˵���÷�Ӧ���ƻ�1mol CO��2mol H2�Ļ�ѧ�����յ�����С���γ�1mol CH3OH�ͷŵ���������ȷ�𰸣�����
��5������ͼ����֪CH3OH�Dz���,�淴Ӧ�������ʵ�������,ƽ��ʱ���ʵ���Ϊ0.013 mol������1mol CH3OH(g)���ų�������Ϊ116 kJ��������0.013 mol CH3OH(g)���ų�������Ϊ116��0.013= 1.508 kJ����ȷ�𰸣�1.508��

����Ŀ��������ͼ��ʾװ�ý�����������ʵ�飬�����õ���Ӧʵ����۵���
ѡ�� | �� | �� | �� | ʵ����� |
|
A | Ũ���� | Na2SO3 | ����KMnO4��Һ��dz | SO2�л�ԭ�� | |
B | Ũ���� | KMnO4 | FeBr2��Һ��Ϊ��ɫ | �����ԣ�Cl2 >Br2 | |
C | ϡ���� | ̼���� | CaCl2��Һ�����Ա仯 | CO2����CaCl2��Ӧ | |
D | Ũ���� | ���� | ��ˮ��ɫ | Ũ���������ˮ�ԡ�ǿ������ |
A. A B. B C. C D. D
����Ŀ����¯���������з�������Ҫ��ӦΪ ![]() Fe2O3��s��+CO��g��=
Fe2O3��s��+CO��g��= ![]() Fe��s��+CO2��g����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
Fe��s��+CO2��g����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
�¶�/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H0�����������������=������
��2����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⣮���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ����v��CO2��=��CO��ƽ��ת����=��
��3������ߣ�2����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
A.����Fe����
B.����Fe203����
C.�Ƴ�����CO2
D.��߷�Ӧ�¶�
E.��С�������ݻ�
F.������ʵĴ�����