题目内容
【题目】下列各组离子在指定条件下能大量共存的是
A. 氢氧化铁胶体中: H+、Cu2+、Cl-、NO3-
B. pH=1的溶液中:Na+、CH3COO﹣、Cl﹣、Cu2+
C. 使紫色石蕊试液变蓝的溶液中:K+、Cl-、NO3-、HCO3-
D. 澄清透明溶液中:Cu2+、K+、NO3﹣、SO42﹣
【答案】D
【解析】A. 氢氧化铁胶体中,氢氧化铁胶体与氢离子反应,不能共存,A错误;B. pH=1的溶液中,存在大量氢离子,故CH3COO﹣不能共存,B错误;C. 使紫色石蕊试液变蓝的溶液中,存在大量氢氧根离子,故HCO3-不能共存,C错误;D. 澄清透明溶液中:Cu2+、K+、NO3﹣、SO42﹣可以大量共存,D正确。

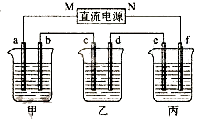
【题目】探究并回答问题
(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| A | B | C | D | E | F |
4molL﹣1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= , V6= , V9=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
(2)在100℃和200kPa的条件下,反应aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
压强(kPa) | 200 | 500 | 1 000 |
B的浓度(molL﹣1) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡移动(填“正向”“逆向”或“不”),理由是 .
②压强从500kPa增加到1 000kPa时,平衡转移(填“正向”“逆向”或“不”),其原因可能是 .
【题目】近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应:CO(g)+2H2(g)![]() CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CH3OH) (mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(1)下图中表示CH3OH的浓度变化的曲线是_________(填字母)。
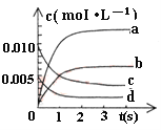
(2)用H2表示从0~2s内该反应的平均速率v(H2) =__________。随着反应的进行,该反应的速率在逐渐减慢的原因是 _____________。
(3)能说明该反应已达到平衡状态的是________。
a.容器内CO与CH3OH的浓度相等 b.v逆(CO) = v正(H2)
c.容器内气体的密度保持不变 d.容器内气体的压强不变
(4)该反应是一个放热反应,说明该反应中破坏1mol CO和2mol H2的化学键吸收的能量_________形成1mol CH3OH释放的能量(填“﹤”、“=”或“﹥”)。
(5)已知在400 ℃时,反应CO(g)+2H2(g)![]() CH3OH(g) 生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q =_________kJ。
CH3OH(g) 生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q =_________kJ。