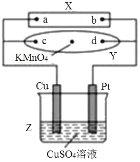
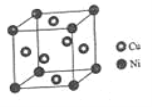
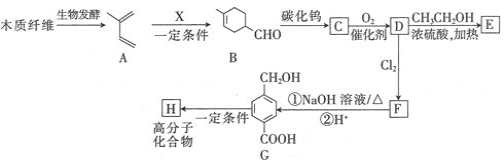
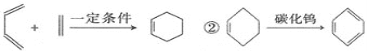
题目内容
【题目】25℃时,0.005molL﹣1Ba(
OH)
2溶液的pH值为( )
A.10B.11C.12D.13
【答案】C
【解析】
氢氧化钡为二元强碱,氢氧根离子浓度为氢氧化钡浓度的两倍,25℃时,0.005mol·L-1Ba(OH)2溶液,则溶液中氢氧根离子浓度=0.01mol·L-1,根据Kw=c(H+)×c(OH-)=1.0×10-14,计算c(H+),根据PH=-lgc(H+)计算。
氢氧化钡为二元强碱,氢氧根离子浓度为氢氧化钡浓度的两倍,25℃时,0.005mol·L-1Ba(OH)2溶液,则溶液中氢氧根离子浓度=0.01mol·L-1,根据Kw=c(H+)×c(OH-)=1.0×10-14,计算c(H+)=![]() =10-12mol·L-1,PH=-lgc(H+)=12,
=10-12mol·L-1,PH=-lgc(H+)=12,
故选:C。

练习册系列答案
相关题目