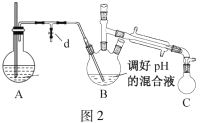
题目内容
【题目】化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题:
(1)B的分子式为C2H4O2,分子中只有一个官能团.则B的结构简式是 ,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是 ,该反应的类型是 ;写出两种能发生银镜反应的B的同分异构体的结构简式 .
(2)C是芳香化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是 .
(3)已知C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是 .另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是 .
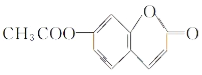
(4)A的结构简式是 .
【答案】(1)CH3COOH,CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,取代反应或酯化反应,HOCH2CHO、HCOOCH3;(2)C9H8O4(3)碳碳双键和羧基,
CH3COOCH2CH3+H2O,取代反应或酯化反应,HOCH2CHO、HCOOCH3;(2)C9H8O4(3)碳碳双键和羧基,![]() (4)
(4)
【解析】
化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C,说明A中含有酯基,B的分子式为C2H4O2,分子中只有一个官能团,所以B是乙酸,乙酸和乙醇能发生酯化反应生成乙酸乙酯D;
C是芳香化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,根据C中碳氢氧的含量确定其分子式;
C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,说明该支链上含有碳碳双键和羧基,另外两个取代基相同,分别位于该取代基的邻位和对位,根据C中原子个数确定该取代基名称,根据B和C物质确定A物质名称,从而写出其结构简式.
解:(1)化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C,说明A中含有酯基,B的分子式为C2H4O2,分子中只有一个官能团,所以B的结构简式是CH3COOH,在加热、浓硫酸催化下乙酸和乙醇反应生成乙酸乙酯D,该反应的化学方程式是CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,该反应的类型是取代反应或酯化反应;能发生银镜反应的,说明B的同分异构体中含有醛基,则结构简式为HOCH2CHO、HCOOCH3,
CH3COOCH2CH3+H2O,该反应的类型是取代反应或酯化反应;能发生银镜反应的,说明B的同分异构体中含有醛基,则结构简式为HOCH2CHO、HCOOCH3,
故答案为:CH3COOH,CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,取代反应或酯化反应,HOCH2CHO、HCOOCH3;
CH3COOCH2CH3+H2O,取代反应或酯化反应,HOCH2CHO、HCOOCH3;
(2)C是芳香化合物,说明C中含有苯环,相对分子质量为180,其碳的质量分数为60.0%,则含碳原子个数为9,氢的质量分数为4.4%,含氢原子个数为8,其余为氧,则O原子个数为4,则C的分子式是C9H8O4,
故答案为:C9H8O4;
(3)C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团说明含有碳碳双键;能与碳酸氢钠溶液反应放出气体的官能团,说明含有羧基;另外两个取代基相同,根据分子式,可推算出另外的官能团为羟基;其分别位于该取代基的邻位和对位,则C的结构简式是![]() ,
,
故答案为:碳碳双键和羧基,![]() ;
;
(4)A能水解再酸化生成B和C,根据B和C的结构简式知,A的结构简式是 ,
,
故答案为: .
.

【题目】煤炭燃烧时产生大量SO2、NO对环境影响极大。
(1)使用清洁能源可有效减少SO2等的排放。煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
ii:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+b kJ/mol
CO(g)+H2O(g) ΔH2=+b kJ/mol
iii:CO(g)+2H2(g) ![]() CH3OH(g) ΔH3
CH3OH(g) ΔH3
ΔH3=________。
(2)在密闭容器中进行反应i,改变温度时,该反应中的所有物质都为气态,起始温度、体积相同(T1 ℃、2 L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ恒 温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ绝 热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡后,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)________K(Ⅱ)(填“>”“<”或“=”下同);平衡时CO2的浓度c(Ⅰ)________c(Ⅱ)。
②对反应Ⅰ,在其他条件不变下,若30 min时只改变温度为T2 ℃,再次平衡时H2的物质的量为2.5 mol,则T1________T2(填“>”“<”或“=”)。
③若30 min时只向容器中再充入1 mol H2(g)和1 mol H2O(g),则平衡________移动(填“正向”“逆向”或“不”)。
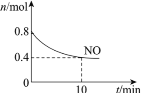
(3)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO发生该反应,如图为容器内的压强(p)与起始压强(p0)的比值(p/p0)随时间的变化曲线。
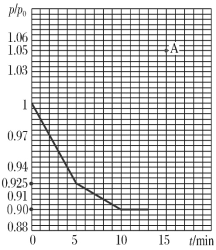
①0~5 min内,该反应的平均反应速率v(NO)=________;平衡时N2的产率为________。
②若13 min时,向该容器中再充入0.06 mol CO2,15 min时再次达到平衡,此时容器内![]() /
/![]() 的比值应在图中A点的________(填“上方”或“下方”)。
的比值应在图中A点的________(填“上方”或“下方”)。