题目内容
20.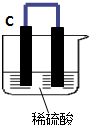 如图所示,将锌、铜通过导线相连置于稀硫酸中.
如图所示,将锌、铜通过导线相连置于稀硫酸中.(1)锌片电极反应为:Zn-2e-=Zn2+.
(2)铜片上的现象是:铜片上有气泡产生.
(3)当通过导线的电子为0.8mol时,收集到氢气标况下的体积是8.96L.
(4)若将电解质溶液换成氯化铁溶液,能否形成原电池?若能,请写出正极反应式Fe3++e-=Fe2+;若不能请说明理由.
分析 该原电池中,Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑,导致负极上金属逐渐减少,正极上有气泡产生,电子从负极流向正极,据此分析解答.
解答 解:(1)该原电池中,Zn易失电子作负极、Cu作正极,负极上铁失电子发生氧化反应生成锌离子进入溶液,电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(2)Cu作正极,正极上电极反应式为2H++2e-=H2↑,故铜片上有气泡产生,故答案为:铜片上有气泡产生;
(3)负极失去电子经过导线流向正极,故答案为:由锌片经导线流向铜电极;
(4)正极:2H++2e-=H2↑,每当有2mol电子转移生成1mol氢气,故转移电子为0.8mol时,故生成氢气体积为:0.8mol2mol0.8mol2mol×22.4L/mol=8.96L,故答案为:8.96L;
(5)电解质若换成氯化铁溶液,铁离子氧化性比氢离子强,故优先放电,正极反应方程式为:Fe3++e-=Fe2+,此反应为氧化还原反应,故可以形成原电池,故答案为:Fe3++e-=Fe2+.
点评 本题主要考查了原电池,明确正负极的判断方法及电极上发生的反应是解本题关键,根据电极反应确定发生的现象,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.已知:2Fe+3Cl2点燃_点燃–––––2FeCl3,下列说法正确的是(设NA为阿伏加德罗常数的值)( )
| A. | 氯气是氧化剂,FeCl3是还原剂 | |
| B. | 常温下,与56g Fe反应断裂1.5NA个Cl-Cl键 | |
| C. | 1 L 0.1 mol•L-1 FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 常温常压下,22.4 L Cl2和足量Fe反应转移3NA个电子 |
11.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热量.据此试判断下列结论正确的是( )
| A. | 金刚石比石墨稳定 | B. | 石墨比金刚石稳定 | ||
| C. | 1mol石墨比1mol金刚石的总能量低 | D. | 1mol石墨比1mol金刚石的总能量高 |
8.下列化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲烷的比例模型: | ||
| C. | 硫化钾的电子式: | D. | CO2的结构式:O-C-O |
15.在一密闭容器中充入一种气态烃和足量的氧气,用电火花点燃完全燃烧后,容器内气体体积保持不变,若气体体积均在120℃和相同的压强下测定的,这种气态烃可能是( )
| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C3H6 |
9.氨水中存在的粒子有( )
①NH3 ②NH3•H2O ③H2O ④OH- ⑤NH+4 ⑥H+.
①NH3 ②NH3•H2O ③H2O ④OH- ⑤NH+4 ⑥H+.
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
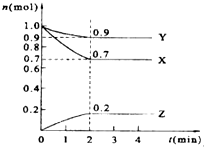 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.