题目内容
9.某烃经催化加氢后得到2-甲基丁烷,该烃不可能是( )①3-甲基-1-丁炔 ②2-甲基-1,3-丁二烯 ③2-甲基-1-丁炔 ④3-甲基-2-丁烯.
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
分析 根据不饱和的加成原理,不饱和键断开,结合H原子,生成2-甲基戊烷,采取倒推法相邻碳原子之间各去掉1个氢原子形成双键,即得到烯烃,或者各去掉2个H原子还原C≡C,还可能为二烯烃,据此进行分析.
解答 解:2-甲基丁烷的碳链结构为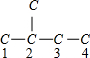 ,若为炔烃,只能在3,4号C添加碳碳三键,其名称为:3-甲基-1-丁炔;
,若为炔烃,只能在3,4号C添加碳碳三键,其名称为:3-甲基-1-丁炔;
若为烯烃:在1、2号碳原子之间为添加双键,其名称为:2-甲基-1-丁烯;
在2、3号碳原子之间添加双键,其名称为:2-甲基-2-丁烯;
在3、4号碳原子之间添加双键,其名称为:3-甲基-1-丁烯;
若为二烯烃,则在1、2和3、4号C添加双键,其名称为:2-甲基-1,3-丁二烯;
根据分析可知,可能的为①②,不可能的为③④,
故选D.
点评 本题考查加成反应原理及其应用,题目难度较大,明确加成反应原理为解答关键,注意掌握常见有机物结构与性质,要求学生能够根据反应产物及反应原理判断反应物结构.

练习册系列答案
相关题目
17.下列关于乙醇的说法不正确的是( )
| A. | 乙醇是一种有机物,分子式为C2H6O | |
| B. | 某白酒标签上标有“53°”字样,它表示100g该酒中含有53g酒精 | |
| C. | 乙醇与水能任意比互溶,不可用来萃取溴水中的溴 | |
| D. | 医用酒精含乙醇一般为75%,常用于擦洗伤口灭菌消毒 |
18.下列物质只表现氧化性的是( )
| A. | H2SO4 | B. | HCl | C. | KMnO4 | D. | HNO3 |
17. 2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:
2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:
(1)现已知下列反应:
①N2(g)+O2(g)═2NO(g)△H1=+180.8kJ/mol
②2C(s)+O2(g)═2CO(g)△H2=-221.2kJ/mol
③C(s)+O2(g)═CO2(g)△H3=-393.6kJ/mol
则△H与△H1、△H2、△H3之间的关系是:△H=2△H3-△H2-△H1,反应2NO(g)+2CO(g)═N2(g)+2CO2(g)属于放热反应.(填“吸热”或“放热”)
(2)为了测定在某种催化剂作用下的反应速率,某研究性学习小组在技术人员的指导下,收集一定量的汽车尾气,并将其转入催化反应器,在某温度下,用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
前2s内的平均反应速率v(CO)=8.5×10-4mol/(L.s);
(3)该小组还研究了向绝热、恒容的密闭容器中通入CO、NO使其在一定条件下发生反应,测得正反应的速率如下图所示,t1=△t2,则:
①NO的转化率在a~b段和b~c段的转化率关系为:αa-b<αb-c(填“>”、“<”或“=”).
②a、b、c、d四个点,哪个点表示化学反应达到平衡状态d;
③解释c点前后速率变化的原因这是一个放热反应,一开始反应放出热量使体系的温度升高,此时温度是影响反应速率的主要因素,随温度的升高,反应速率加快,所以一开始时反应速率在增大;c点后随反应的进行反应物的浓度减少,反应物浓度的变化是影响化学反应速率的主要因素,所以c点后反应速率减少..
 2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:
2014年10月,北京、哈尔滨等多个北方城市出现严重雾霾天气,多所学校被迫停课,造成雾霾的“罪魁”之一是汽车尾气.当今汽车尾气处理主要经三元催化器处理,其主要污染物(CO、NOx,碳氢化合物)可自发的相互反应变成无害气体,减少环境污染,其反应原理之一:2NO(g)+2CO(g)═N2(g)+2CO(g)△H,回答下列问题:(1)现已知下列反应:
①N2(g)+O2(g)═2NO(g)△H1=+180.8kJ/mol
②2C(s)+O2(g)═2CO(g)△H2=-221.2kJ/mol
③C(s)+O2(g)═CO2(g)△H3=-393.6kJ/mol
则△H与△H1、△H2、△H3之间的关系是:△H=2△H3-△H2-△H1,反应2NO(g)+2CO(g)═N2(g)+2CO2(g)属于放热反应.(填“吸热”或“放热”)
(2)为了测定在某种催化剂作用下的反应速率,某研究性学习小组在技术人员的指导下,收集一定量的汽车尾气,并将其转入催化反应器,在某温度下,用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
| 时间/s | 0 | 2 | 3 | 4 |
| C(NO0(×10-4mol•L-1) | 20.0 | 3.00 | 2.00 | 2.00 |
| C(CO)(×10-3mol•L-1) | 2.70 |
(3)该小组还研究了向绝热、恒容的密闭容器中通入CO、NO使其在一定条件下发生反应,测得正反应的速率如下图所示,t1=△t2,则:
①NO的转化率在a~b段和b~c段的转化率关系为:αa-b<αb-c(填“>”、“<”或“=”).
②a、b、c、d四个点,哪个点表示化学反应达到平衡状态d;
③解释c点前后速率变化的原因这是一个放热反应,一开始反应放出热量使体系的温度升高,此时温度是影响反应速率的主要因素,随温度的升高,反应速率加快,所以一开始时反应速率在增大;c点后随反应的进行反应物的浓度减少,反应物浓度的变化是影响化学反应速率的主要因素,所以c点后反应速率减少..
14.下列有关溴乙烷的说法正确的是( )
| A. | 溴乙烷的电子式 | |
| B. | 向溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| C. | 溴乙烷与KOH溶液反应:CH3CH2Br+H2O$→_{△}^{KOH}$C2H5OH+KBr | |
| D. | 用溴乙烷制取乙二醇经过以下几步:消去→加成→水解 |
18.下列反应的离子方程式正确的是( )
| A. | HSO3-在溶液中发生水解:HSO3-+H2O?SO32-+H3O+ | |
| B. | 向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O═SO32ˉ+2HClO | |
| C. | 苯酚钠溶液显碱性:C6H5O-+H2O?C6H5OH+OH- | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ OH-+Cl2↑+H2↑ |
19.以下化学用语中,错误的是( )
| A. | 乙醛的分子式:C2H4O | B. | 苯的结构简式: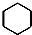 | ||
| C. | 乙炔的结构简式:CH≡CH | D. | 乙醇的结构简式:C2H5OH |
 ,试回答下列各题:
,试回答下列各题: B.
B.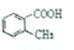 C.
C.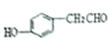 D.
D.



 .
.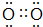 .
.