题目内容
【题目】“一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础。
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式:___________________。
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4 (g)![]() N2(g)+4NH3(g)
N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是_________________
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c. N2H4 和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
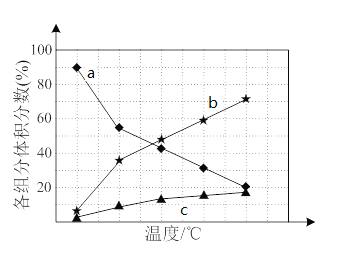
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示,其中曲线b表示的是________(物质的化学式)的体积分数随温度的变化情况,为抑制肼的分解,可采取的合理措施有___________________(任写一种)。
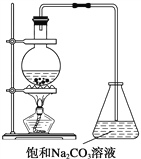
(3)大气污染气的主要成分是SO2和NO2。利用下图所示装置(电极均为惰性电极)可以吸收SO2,还可以用阴极排出的溶液吸收NO2。
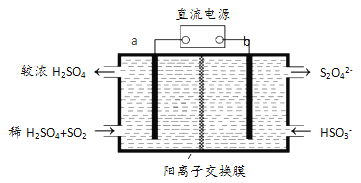
a极为 _________(填“阴”“阳”) b极的电极反应式为__________________。简述该装置能吸收SO2的原理:_____________________。
【答案】 FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1 2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O a c d NH3 降低反应温度或增加压强等 阳极 2HSO3- +2e- = S2O42-+2OH- 或2HSO3- +2e-+ 2H+ = S2O42-+2H2O SO2在 a极发生氧化反应,电极反应式:SO2-2e-+2H2O =4H++ SO42-,H+通过阳离子交换膜进入b 极室。
【解析】(1)Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol…①,3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol…②,Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol…③,根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1-△H2-2×△H3)÷6=-11KJ/mol;
(2)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
②a.反应前后气体的化学计量数之和不等,混合气体的总物质的量随反应的进行不断变化,则容器内压强不随时间改变,说明是平衡状态,故a正确;b.单位时间内生成amol N2的同时,生成4molNH3,均为正反应速率,无法判断是平衡状态,故b错误;c. N2H4 和NH3的系数不等,当物质的量之比保持不变时,此反应为平衡状态,故c正确;d.混合气体的质量始终是定值,但混合气体的总物质的量不确定,当混合气体的平均摩尔质量保持不变,说明是平衡状态,故d正确;答案为acd;
图中曲线a的体积分数减小说明是反应物,b和c曲线对应的体积分数增大,说明是生成物,其中b的体积分数大于c,则b为NH3的体积分数;由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度,另外增大压强平衡也能逆向移动;
(3)依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,即a为阳极,b为阴极区,HSO3-发生还原反应,电极反应式为2HSO3- +2e- = S2O42-+2OH- 或2HSO3- +2e-+ 2H+ = S2O42-+2H2O;该装置中SO2在a极发生氧化反应,电极反应式:SO2-2e-+2H2O =4H++ SO42-,H+通过阳离子交换膜进入b极室。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案