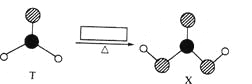
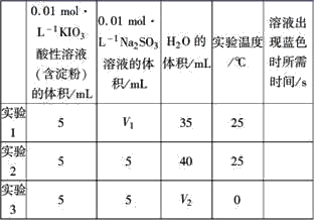
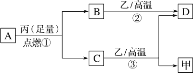
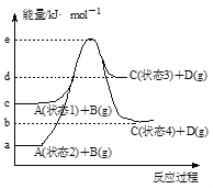
题目内容
【题目】在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:下列说法正确的是( )
3C(g)。反应过程中的部分数据如下表所示:下列说法正确的是( )
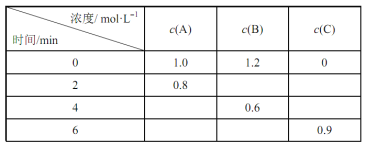
A.在0~2min内,B的反应速率为0.1mol·Lˉ1·minˉ1
B.2min时,C的物质的量浓度为0.4mol·L-1
C.4min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D.在4~6min内,容器内气体分子的总物质的量不变
【答案】D
【解析】
A.在0~2min内,Δc(A) = 0.2 mol·L1,Δc(B) = 0.4 mol·L1,B的反应速率![]() ,反应A错误;
,反应A错误;
B.2min时,Δc(A) = 0.2 mol·L1,则Δc(A) = 0.6 mol·L1,即C的物质的量浓度为0.6mol·L1,故B错误;
C.4min时,反应已达到平衡状态,此时正、逆反应的速率不为0,故C错误;
D.4min时,反应已达到平衡状态,因此在4~6min内,容器内气体分子的总物质的量不变,故D正确。
综上所述,答案为D。

【题目】CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2 (g) (慢反应)
C(ads)+2H2 (g) (慢反应)
反应②:C(ads)+ CO2(g)![]() 2CO(g) (快反应)
2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

(1)CH4与CO2制备“合成气”的热化学方程式为_________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+
CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+![]() (Kc为化学平衡常数;T 为热力学温度,单位为K)。
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
(2)反应达到平衡后,仅升高温度,k正增大的倍数_________ k逆增大的倍数(填“>”、“<”或“=”)。
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_________(填标号)。
A <![]() B
B ![]() C >
C >![]() D 无法确定
D 无法确定