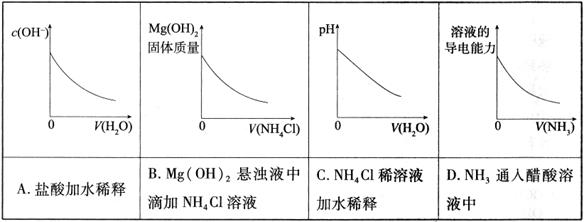
题目内容
相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A.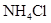 | B. | C. | D.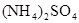 |
C
解析试题分析:NH4Cl和(NH4)2SO4对比,水解都呈酸性,(NH4)2SO4pH较小;NH4HCO3水解呈碱性,pH最大;NH4HSO4为酸式盐,HSO4-完全电离,溶液酸性最强,则pH最小。
考点:盐类水解的应用

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
下列说法正确的是
| A.在温度不变时,水溶液中c(H+)和c(OH-)不能同时增大 |
| B.pH=0的溶液是酸性最强的溶液 |
| C.强酸的水溶液中不存在OH- |
| D.某温度下,纯水中c(H+)=2×10-7mol·L-1,其呈酸性 |
为证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是
| A.室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 |
| B.室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 |
| C.相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
| D.将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是
| A.1 mol/L氢氰酸溶液的pH约为3 |
| B.常温下,pH=a的HCN稀释100倍后所得溶液pH<(a +2)[(a +2)<7] |
| C.10 mL 1 mol/L HCN恰好与10 mL 1 mol/L NaOH溶液完全反应 |
| D.NaCN溶液呈碱性 |
常温下,下列溶液中的粒子浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
C.25℃时,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液pH=4.75,c(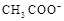 )+c( )+c(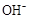 )=c(CH3COOH)+c(H+) )=c(CH3COOH)+c(H+) |
| D.一定物质的量浓度的Na2S溶液中:c(OH-) =c(H+)+2c(H2S) + c(HS-) |
下列根据反应原理设计的应用,不正确的是
A.CO32-+H2O HCO3-+OH- 热的纯碱溶液清洗油污 HCO3-+OH- 热的纯碱溶液清洗油污 |
B.Al3++3H2O Al(OH)3(胶体)+3H+ 明矾净水 Al(OH)3(胶体)+3H+ 明矾净水 |
| C.Al3++3HCO3-=Al(OH)3↓+3CO2↑ 泡沫灭火器灭火 |
| D.SnCl2+H2O=Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(aq) H+(aq) + In-(aq)
H+(aq) + In-(aq)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,
其中能使指示剂显红色的是
| A.①④ | B.②⑤⑥ | C.①④⑤ | D.②③⑥ |
下列溶液一定呈中性的是
| A.c(H+)=c(OH-)=10-6mol/L的溶液 |
| B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |