题目内容
室温下,下列图形与实验过程相符合的是
B
解析试题分析:盐酸稀释时氢离子浓度减小,但OH-离子的浓度增大,与图象中随水的量增加OH-离子的浓度减小不符,故A错误;氯化铵与氢氧根离子反应生成弱电解质,促进氢氧化镁的溶解,则固体的质量减小,所以Mg(OH)2悬浊液中滴加NH4Cl溶液,固体质量在减小,与图象一致,故B正确;加水促进氯化铵中铵根离子的水解,生成的n(H+)增大,但n(H+)减小,所以pH增大,而图象中pH减小,与图象不符,故C错误;醋酸为弱电解质,通入氨气时生成醋酸铵,为强电解质,离子浓度增大,所以导电性增强,而图象中导电性减小,与图象不符,故D错误;故选B.
考点:考查了弱电解质的电离及图象问题,明确电离、水解、pH、溶液的导电性等知识。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
常温下,pH值为11的NaOH溶液与pH值为11的CH3COONa溶液中,水电离的c(OH-)之比为
| A.1∶1011 | B.1∶103 | C.1∶108 | D.108∶1 |
测定CuSO4?nH2O的结晶水含量,方法是:称量样品→ 在坩埚中加热→ 冷却→ 称量无水盐。若用相同方法测试下列晶体中的结晶水含量,可行的是
| A.Cu(NO3)2?nH2O | B.MgCl2?nH2O | C.MgSO4?nH2O | D.FeSO4?nH2O |
设某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,且X>11,将上述两溶液分别取等体积充分混合,混合液中各离子的浓度由大到小的顺序是
| A.c(Cl-)>c(NH4+)>c(H+) >c(OH-) |
| B.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
水的电离平衡为H2O  H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
| B.溶液中c(OH-)增大 |
| C.醋酸的电离程度增大,c(H+)增大 |
| D.再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A. | B. | C.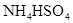 | D. |
室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
| A.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B.使温度都升高20℃后,两溶液的pH均不变 |
| C.加水稀释2倍后,两溶液的pH均减小 |
| D.加足量的锌充分反应后,两溶液产生的氢气一样多 |