��Ŀ����
Ϊ֤��ij������һԪ�ᣨHX�������ᣬ������ʵ�鷽�������в���������
| A�������£���0.1 mol/L HX��Һ��pH����pH��1��֤��HX������ |
| B�������£���1 mol/L NaX��Һ��pH����pH��7��֤��HX������ |
| C����ͬ�����£���0.1 mol/L��HCl��0.1 mol/L��HX���е�����ʵ�飬����HX��Һ�മ���ĵ��ݽϰ���֤��HXΪ���� |
| D������Ũ�ȡ��������HCl��NaX��Һ��ϣ��������ҺpH<7��֤��HX������ |
D
�������������A. C(HX)=" 0.1" mol/L,PH��1,˵��C(H+)<0.1 mol/L, HX���ֵ��룬�ʿ���֤��HX�����ᣬ���������⡣����B��HX��ǿ�ᣬ��NaXΪǿ��ǿ���Σ�������ˮ�ⷴӦ�����ƻ�ˮ�ĵ���ƽ�⣬PH=7.���ڲ�1 mol/L NaX��Һ��pH����pH��7��˵��X-������ˮ���������H+���ƻ���ˮ�ĵ���ƽ�⣬ʹ��Һ�Լ��ԡ�֤��HX�����ᡣ���������⡣����C. HCl��ǿ�ᡣ��ͬ�����£���0.1 mol/L��HCl��0.1 mol/L��HX���е�����ʵ�飬����HX��Һ�മ���ĵ��ݽϰ���˵����Һ�е����ӵ�Ũ��С�����������������ʿ�֤��HXΪ���ᡣ���������⡣����D. ����HCl��ǿ�ᣬ��������NaX��ǿ�������λ���ǿ�������Σ�����Ũ�ȡ��������HCl��NaX��Һ��ϣ������Һ��pH���п���ΪPH<7�����Բ���֤��HX�����ᡣ�������⡣��ȷ��
���㣺�������ǿ����ʡ�������ʵ��жϵ�֪ʶ��

������������������Һ����0.1 mol/L��ˮ ��0.1 mol/L NH4Cl��Һ �ۻ����Һ�������NH4Cl��Ũ�Ⱦ�Ϊ0.1 mol/L �ܻ����Һ��NaOH�Ͱ�ˮ��Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ��c(NH4��)�ɴ�С������ȷ����
| A���ڢۢܢ� | B���ڢ٢ۢ� | C���ۢڢܢ� | D���ۢڢ٢� |
��ij��ˮ��pH��X��ij�����pH��Y����֪X��Y��14����X��11������������Һ�ֱ�ȡ�������ֻ�ϣ����Һ�и����ӵ�Ũ���ɴ�С��˳����
| A��c(Cl��)��c(NH4+)��c(H��) ��c(OH��) |
| B��c(NH4+)��c(Cl��)��c(H��)��c(OH��) |
| C��c(NH4+)��c(Cl��)��c(OH��)��c(H��) |
| D��c(Cl��)��c(NH4+)��c(OH��)��c(H��) |
��������10mLpH=3�Ĵ�����Һ�м�ˮϡ�ͺ�����˵����ȷ����
| A����Һ�е������ӵ���Ŀ���� |
| B����Һ��c��OH-������ |
| C������ĵ���̶�����c��H+������ |
| D���ټ���10mLpH=11��NaOH��Һ�����Һ��pH=7 |
�������Һ����������֮������ֻ������˼����������ᵽ������Ȥ�����й��ڵ������Һ����������ȷ����
| A��Na2CO3��NaHCO3��������Һ�У����������ͬ |
| B�������£�1mol/L��CH3COOH��Һ��1mol/L��NaOH��Һ�������ϣ����û��Һ�У�c(Na+) ��c(CH3COO-) ��c��H+����c(OH-) |
| C�����ʵ���Ũ����ͬ��NH4Cl��NH4HSO4������Һ�У�c(NH4+)ǰ��С�ں��� |
| D�������£�ij��Һ����ˮ�������c(H+)=10-51mol��L-1�������Һ���������� |
��ͬ�¶��µ����ʵ���Ũ�ȵ�������Һ�У�pHֵ��С����
A�� | B�� | C��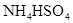 | D�� |
���з�Ӧ�У�����ˮ�ⷴӦ����д��ȷ����
A��CH3COOH��OH�� CH3COO��+H2O CH3COO��+H2O |
B��HCO3��+ H2O  CO32- + H3O+ CO32- + H3O+ |
C��NH4+ + H2O  NH3��H2O + H+ NH3��H2O + H+ |
D��S2- + H2O H2S+ OH- H2S+ OH- |
100mL 0.2 mol/L NH4Cl��Һ������pHΪa��������ˮϡ����1L����Һ�йر仯�������
| A��c��NH4Cl����Ϊ0.02mol/L | B��ˮ�ĵ���̶ȱ�� |
| C��n��Cl-���ޱ仯 | D��pHС��a+1 |
һ���¶��£��ס�����ƿ��ˮ��Ũ�ȷֱ�Ϊ1mol/L��0.1mol/L����ס�����ƿ��ˮ��c(OH��)
֮��Ϊ
| A������10 | B��С��10 | C������10 | D����ȷ�� |