题目内容
氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是
| A.1 mol/L氢氰酸溶液的pH约为3 |
| B.常温下,pH=a的HCN稀释100倍后所得溶液pH<(a +2)[(a +2)<7] |
| C.10 mL 1 mol/L HCN恰好与10 mL 1 mol/L NaOH溶液完全反应 |
| D.NaCN溶液呈碱性 |
C
解析试题分析:氢氰酸为弱电解质,则利用其电离不完全来分析,一般测定溶液的pH或测定相同条件下与强酸的导电性比较来判断。A、氢氰酸为一元酸,1mol/L氢氰酸溶液的pH=0时该酸为强酸,但pH约为3,说明电离生成的氢离子约为10-3mol/L<1mol/L,电离不完全,故A可以说明是弱电解质;B、常温下,pH=a的HCN稀释100倍后,如果是强酸,则稀释后的pH=a+2,但实际上所得溶液pH<(a +2)[(a +2)<7],这说明电离不完全,故B可以说明是弱电解质;C、10mL1mol/LHCN恰好与10mL1mol/LNaOH溶液完全反应,只能说明HCN为一元酸,不能说明其电离的程度,故C错误;D、NaCN溶液显碱性,说明CN-在溶液中水解使溶液显碱性,则对应的酸HCN是弱酸,故D可以说明是弱电解质,答案选C。
考点:考查弱电解质的判断

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案运用电离常数判断可以发生的反应是
| 酸 | 电离常数(25oC) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
A.HBrO+Na2CO3→NaBrO+NaHCO3
B.2HBrO+Na2CO3→2NaBrO+H2O+CO2↑
C.HBrO+NaHCO3→NaBrO+H2O+CO2↑
D.NaBrO+CO2+H2O→NaHCO3+HBrO
水的电离平衡为H2O  H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是( )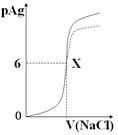
(提示:KspAgCl>KspAgI)
| A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 |
| B.图中x点的坐标为(100,6 ) |
| C.图中x点表示溶液中Ag+ 与Cl- 浓度相同 |
| D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分 |
相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A.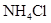 | B. | C. | D.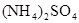 |
物质的量浓度相同的下列溶液中, NH4+浓度最大的是
| A.NH4Cl | B.CH3COONH4 | C.NH4HSO4 | D.NH4HCO3 |
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH—)+c(NH3·H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl—)>c(OH—)>c(H+) |
室温下,在0.01mol/L的Na2CO3溶液中,水的离子积常数(KW)为
| A.1×10—14 | B.大于1×10—14 | C.小于1×10—14 | D.无法确定 |
25℃时,弱酸的电离平衡常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
下列有关说法正确的是( )
A.等物质的量浓度的各溶液的pH关系为: pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol/L HCN与a mol/L NaOH溶液等体积混合后所得溶液呈中性
C.往冰醋酸中逐滴加水稀释,溶液导电能力始终保持减小
D.在Na2CO3溶液中:c(OH-)- c(H+)= c(HCO3-) + 2c(H2CO3)