题目内容
【题目】BaCl2xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如下图所示。
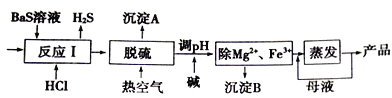
已知: 室温时Ksp[Mg(OH)2]= 1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)写出氯化钡的电子式______,盐酸和硫化钡反应的化学方程式为___________。
(2)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为_______________________。
(3)沉淀A的成分是__________。
(4)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________________。
(5)室温时,若加碱调溶液pH至9,则完全沉淀的离子是_____________(写出计算过程)。
【答案】 ![]() BaS+2HCl=BaCl2+H2S↑ 2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓ S(或硫) S2O32-+2H+=S↓+SO2↑+H2O Fe3+,室温时,pH=9 c(OH-)=10-5mol/L 由Ksp[Fe(OH)3]=4.0×10-38 得
BaS+2HCl=BaCl2+H2S↑ 2(NH4)2S+O2+2H2O=4NH3·H2O+2S↓ S(或硫) S2O32-+2H+=S↓+SO2↑+H2O Fe3+,室温时,pH=9 c(OH-)=10-5mol/L 由Ksp[Fe(OH)3]=4.0×10-38 得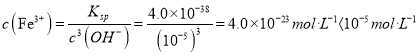 故Fe3+沉淀完全
故Fe3+沉淀完全
【解析】(1)氯化钡的化学式为BaCl2,是离子化合物,Ba的化合价为+2价,Cl的化合价为-1价,故电子式为![]() ;根据强酸制弱酸原理,盐酸和硫化钡反应生成氯化钡和硫化氢气体,所以化学方程式为:BaS+2HCl=BaCl2+H2S↑。
;根据强酸制弱酸原理,盐酸和硫化钡反应生成氯化钡和硫化氢气体,所以化学方程式为:BaS+2HCl=BaCl2+H2S↑。
(2)根据题意,用足量氨水吸收H2S,会生成(NH4)2S,空气中的氧气能将(NH4)2S氧化成硫单质并使吸收液再生(生成NH3H2O),反应的化学方程式为:2(NH4)2S+O2+2H2O=4NH3H2O+2S↓。
(3)反应I中生成的氯化钡溶液中有H2S,鼓入热空气将H2S吹出,同时空气中有氧气,能将部分H2S氧化成S单质而形成沉淀,故沉淀A的成分是S(或硫)。
(4)对S2O32-进行酸化脱硫,S2O32-在酸性条件下发生自身氧化还原反应,生成SO2和硫单质,反应的离子方程式为S2O32-+2H+=S↓+SO2↑+H2O。
(5)室温时加碱调节pH至9,则此时溶液中c(OH-)=10-5mol/L,根据Mg(OH)2和Fe(OH)3的Ksp,c(Mg2+)=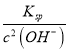 =
=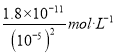 =1.8×10-1
=1.8×10-1![]() >
>![]() ,c(Fe3+)=
,c(Fe3+)=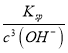 =
= =
=![]() <
<![]() ,故Fe3+沉淀完全。
,故Fe3+沉淀完全。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学反应2AB+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表所示,表中温度为摄氏度(℃).
实验 | 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,回答下列问题:
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为
(2)在实验1中,c1数值为
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验(选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3800(选填“<”或“>”).