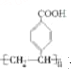
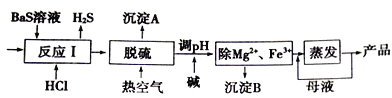
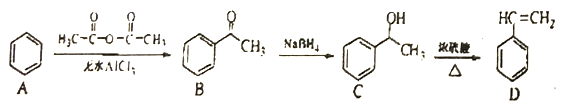题目内容
【题目】下列各种叙述中正确的是( )
A. 在任何条件下,纯水的pH=7 B. 在任何条件下,纯水都呈中性
C. 在90℃时,纯水中pH=7 D. 在50℃时,纯水c(H+)<10-7mol/L
【答案】B
【解析】A.水的电离是吸热反应,常温下水的pH等于7,温度升高,水的电离程度增大,pH=-lg c(H+),100℃时,纯水的c(H+)=1×10-6mol/L,pH=-lg1×10-6=6,故A错误;B.水的电离方程式为:H2O![]() H++OH-,所以在任何条件下,纯水的c(H+)=c(OH-),呈中性,故B正确;C.90℃时,水的Kw=1×10-12,水的电离方程式为:H2O
H++OH-,所以在任何条件下,纯水的c(H+)=c(OH-),呈中性,故B正确;C.90℃时,水的Kw=1×10-12,水的电离方程式为:H2O![]() H++OH-,则c(H+)c(OH-)=1×10-12,纯水中c(H+)=c(OH-),所以c(H+)=c(OH-)=1×10-6mol/L,该温度下,所以纯水的pH=-lg1×10-6=6,故C错误;D.50℃时,水的Kw>1×10-14,水的电离方程式为:H2O
H++OH-,则c(H+)c(OH-)=1×10-12,纯水中c(H+)=c(OH-),所以c(H+)=c(OH-)=1×10-6mol/L,该温度下,所以纯水的pH=-lg1×10-6=6,故C错误;D.50℃时,水的Kw>1×10-14,水的电离方程式为:H2O![]() H++OH-,则c(H+)c(OH-)= Kw>1×10-14,纯水中c(H+)=c(OH-),所以c(H+)=c(OH-)>1×10-7mol/L,故D错误;故选B。
H++OH-,则c(H+)c(OH-)= Kw>1×10-14,纯水中c(H+)=c(OH-),所以c(H+)=c(OH-)>1×10-7mol/L,故D错误;故选B。

练习册系列答案
相关题目
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
气体体积/L | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动